비만과 심폐체력이 여성의 텔로미어 길이에 미치는 영향
초록
이 연구는 비만과 심폐체력이 여성들의 텔로미어 길이에 미치는 영향을 알아보고자 10대부터 50대까지의 여성(N=177)을 대상으로 실시하였다. 연령에 따라 체질량지수, 근육량, 체지방률 및 허리둘레가 유의한 차이를 나타냈고(p<.001), 심폐체력도 연령에 따른 유의한 차이를 나타냈다(p<.001). 연령은 심폐능력(r=-.787, p<.001) 및 텔로미어 길이(r=-.781, p<.001)와 유의한 음의 관련성을 나타내었다. 연령대에 따라 10대(p<.05), 20대(p<.01) 및 40대(p<.05)는 텔로미어 길이와 허리둘레가 유의한 음의 관련성을 나타내었다. 심폐체력과 텔로미어 길이는 40대에서 유의한 양의 관련성을 나타내었다(p<.01). 전체 모든 연령을 대상으로 분석한 결과 텔로미어 길이는 체질량지수, 허리둘레와 유의한 음의 관련성을 나타내고(p<.001), 심폐체력과 유의한 양의 관련성을 나타내었다(p<.001). 결론적으로 연령은 비만지표와 심폐체력 및 텔로미어에 영향을 주고, 연령대에 따른 텔로미어 변화에는 비만지표 중 허리둘레가 젊은 시기와 중년시기 모두 텔로미어에 영향을 주며, 심폐체력은 중년시기인 40대에 영향을 주는 것으로 나타났다. 따라서, 젊은 시기부터 비만을 잘 관리하는 것이 텔로미어 감손을 예방하는 방법이며, 중년 이후의 텔로미어 길이 감손을 예방하기 위해서는 규칙적인 운동을 통해 심폐체력을 관리하는 것이 노화를 예방하는 방법이 될 것으로 제시하는 바이다.
Abstract
This study examined the effects of obesity and cardiorespiratory fitness (CRF) on the telomere length (TL) of women aged 10 to 60 years (N=177). Body composition properties, such as the body mass index, muscle mass, body fat percentage, and waist circumference, and CRF differed considerably with age (p<.001 and p<.001, respectively). Furthermore, age exhibited a significant negative relationship with CRF (r= .787, p<.001) and TL (r=−.781, p<.001). TL exhibited a negative association with the waist circumference in women aged 10 to 20 (p<.05), 20 to 30 (p<.01), and 40 to 50 years (p<.05). TL exhibited a positive association with CRF in women aged 40 to 50 years (p<.01). Furthermore, in all participants, TL exhibited a negative association with the body mass index and waist circumference (p<.001) and a positive association with CRF (p<.001). Overall, age exhibited a strong association with the obesity index, CRF, and TL. The waist circumference of the obesity index affected TL of both young and middle-aged women, and CRF affected women aged 40 to 50. Therefore, obesity management from a young age is the best approach to prevent TL attrition after middle age. We proposed that the improvement of CRF through regular exercise can reduce TL attrition with age.
Keywords:
obesity, cardiorespiratory fitness, women, telomere length키워드:
비만, 심폐체력, 여성, 텔로미어 길이I. 서론
텔로미어는 염색체 말단에 위치한 특정 DNA-단백질 복합체(DNA-protein complex)로 반복적인 헥사뉴클레오티드(hexanucleotide)로 구성된다. 텔로미어는 DNA의 완전한 복제에 필수적이며, 뉴클레아제 분해(nuclease degradation), 세포 말단 간 융합(end-to-end fusion), 세포 노화(cellular senescence)로부터 염색체를 보호하여 염색체의 보존(integrity)과 안정성을 촉진하는데 핵심적인 역할을 한다(Mather, Jorm, Parslow, & Crhistensen, 2011).
정상적인 세포 과정에서 텔로미어는 부분적으로 DNA 합성 시 지연 가닥(lagging strand)의 불완전한 복제로 인하여 각 유사 세포분열(mitotic cell division)마다 점차적으로 짧아지게 된다. 텔로미어가 짧아지게 되면 세포 복제의 노화 신호가 유발되어 세포 주기 정지 또는 세포 사멸을 유발하게 되므로, 나이가 들어감에 따라 인간의 말초 백혈구 텔로미어는 느리고 점진적으로 짧아지게 된다(Mather et al., 2011).
이러한 텔로미어는 전신 염증, 산화스트레스 및 흡연과 같은 특정 건강에 해로운 습관 및 노화 관련 질병과 관련을 갖는다(De Meyer, Rietzschel, De Buyzere, Van Criekinge, & Bekaert, 2011). 특히, 비만은 전신염증 및 산화스트레스를 증가시키고(Furukawa, Fujita, Shimabukuro, Iwaki, Yamada, Nakajima et al., 2004), 이것은 대사와 면역에 다양한 기능이상을 야기하여 노화와 관련된 질병을 촉진시키므로(Greenberg & Obin, 2006; Hotamisligil, 2006), 텔로미어 길이와 관련성이 있는 것으로 보고되었다. 선행연구들은 체질량지수(Müezzinler, Zaineddin, & Brenner, 2014) 및 현재 체중상태와 텔로미어 길이가 역의 관련성을 가지는 것으로 보고하였다(Batsis, Mackenzie, Vasquez, Germain, Emeny, Rippberger et al., 2018; Lee, Martin, Firpo, & Demerath, 2011; Njajou, Cawton, Blackburn, Harris, Li, Sanders et al., 2012; Nordfjäll, Eliasson, Stegmayr, Melander, Nilsson, & Roos, 2008). 그러나 비만과 텔로미어 길이가 관련성이 없다는 연구(Al-Attas, Al-Daghri, Alokail, Alfadda, Bamakhramah, Sabico et al., 2010; Aviv, Valdes, Gardner, Swaminathan, Kimura, & Spector, 2006; Bekaert, De Meyer, Rietzschel, De Buyzere, De Bacquer, Langlois et al., 2007; Bischoff, Petersen, Graakjaer, Andersen-Ranberg, Vaupel, Bohr et al., 2006; Diaz, Mainous, Playe, & Everett, 2011; Kim, Parks, DeRoo, Chen, Taylor, Cawthon, & Sandler, 2009)도 보고되어 비만과 텔로미어의 관련성은 아직까지 불명확하다(Tzanetakou, Katsilambros, Benetos, Mikhailidis, & Perrea, 2012).
이러한 연구보고의 불일치는 비만과 텔로미어의 관계가 질환의 유무에 따라서도 영향을 받기 때문이다. 즉 비만은 심혈관질환의 주요한 위험인자인데, 심혈관질환이 있는 사람은 건강한 사람에 비하여 텔로미어 길이가 짧은 것으로 보고된다(Yeh & Wang, 2016). 또한, 텔로미어 길이는 나이, 체질량지수, 허리둘레, 고혈압, 중성지방, 공복 시 혈당수준과 같은 심혈관질환을 유발하는 요인들과도 역의 관련성을 가지는 것으로 보고되었다(Kim et al., 2009).
반면, 규칙적인 운동은 비만, 고혈압, 제2형 당뇨병 및 심혈관질환의 위험을 감소시킨다. 신체적으로 활동적인 사람의 텔로미어 길이는 같은 연령대와 비교 시 긴 것으로 나타나고, 심폐체력과 양의 관련성을 가지는 것으로 보고되었다(Du, Prescott, Kraft, Han, Giovannucci, Hankinson et al., 2012). 그러나 심폐체력과 텔로미어 길이의 관련성은 15세의 청소년 집단에서는 심폐체력과 텔로미어 길이의 관련성이 없고(Mathur, Ardestani, Parker, Cappizzi, Polk, & Thompson, 2013), 젊은집단(18-32세)에서도 심폐체력에 따른 차이가 없으며(Denham, Nelson, O'Brien, Nankervis, Denniff, Harvey et al., 2013; LaRocca, Seals, & Pierce, 2010), 중년집단(55-72세)에서만 차이가 나타나는 것으로 보고되어(LaRocca et al., 2010) 연령에 따른 차이가 있는 것으로 보고되었다. 따라서 연령대에 따른 심폐체력과 텔로미어의 관련성을 알아볼 필요성이 있다. 또한, 비만율도 연령대에 따라 차이가 있으므로(대한비만학회, 2020) 비만과 텔로미어의 관련성도 연령대에 따른 분석이 필요하다.
이에 이 연구는 10~50대의 여성을 대상으로 연령대에 따른 비만과 심폐체력 수준이 텔로미어 길이에 미치는 영향을 알아보고자 실시되었다.
Ⅱ. 연구 방법
1. 분석 대상
이 연구는 10대부터 50대까지의 여성(N=177)을 대상으로 실시하였다. 대상자들은 신체 건강한 여성으로써 최근 1년간 근골격계 부상 병력이 없는 대상으로 실시하였다. 연구 시작 전에 대상자들에게 연구목적과 연구 진행 방법에 대해 충분히 설명을 한 후 자발적 동의서를 받아 본 연구를 수행하였다(IRB File No:180309-1A).
2. 신체구성 측정
연구 대상자들의 신장, 체중, 체질량지수, 체지방율, 근육량 등은 다중 주파수 생체 전기 임피던스 분석(InBody 770, Biospace Co, Ltd, Seoul, Korea)를 이용하여 측정하였다. 허리둘레는 정상 호기 종료 후 갈비뼈와 장골 돌기사이의 허리둘레(cm)를 측정하였다.
과체중과 비만은 체질량지수를 기준으로 BMI가 23~ 24.9kg/m2인 경우는 과체중으로, BMI가 25kg/m2 이상인 경우는 비만으로 분류하였고, 또한, 허리둘레가 85cm 이상인 경우(대한비만학회, 2020)도 비만으로 분류하였다.
3. 텔로미어 길이 분석
혈액검사를 위해 전완정맥에서 10ml의 혈액을 채혈하였다. 텔로미어 길이는 DNA 주형을 DNA 중합효소를 사용하여 반복적으로 복제하는 원리를 이용하여 분석하며, 정량분석을 위하여 DNA에 형광물질(fluorescence)을 처리하여 single copy gene number에 대한 상대적인 DNA repeat copy number(Ct)값을 구하여 본래의 DNA길이를 측정하는 방법을 이용하였다. 텔로미어 길이의 정량분석을 위하여 Real-Time PCR을 이용하여 Cawthon, Smith, O'Brien, Sivatchenko, & Kerber(2003)에 의해 기술된 방법을 사용하여 single copy gene number에 대한 상대적인 telomere repeat copy number(T/S ratio)를 구하였다. 먼저 Real-Time PCR의 정량을 위하여 2개의 DNA 샘플을 5가지로 희석하여 standard curve를 구하고, 같은 DNA 샘플을 3번씩 분석하며, 매번 동일한 well position이 되도록 하였다. Melt Curve graph와 Standard curve를 그린 후, 희석농도에 따른 DNA의 mean terminal restriction fragment(TFR) lengths의 상관계수를 구하여 reference DNA에 대한 길이를 분석하였다.
4. 심폐체력 측정
심폐체력을 위한 최대산소섭취량 검사는 가스분석기(Vmax ST 1.0)를 이용하여 Bruce protocol(1973)로 실시하였다. 모든 대상자들은 안정 시 심박수와 호흡교환율 측정을 통해 안정 시 상태임을 확인하고 실시하였다. 운동 강도는 운동부하가 증가하여도 피험자의 나 심박수가 증가하지 않고 일정한 수준을 유지하거나 피로하여 더 이상 운동수행을 하지 못할 경우를 최대능력 도달 기준으로 설정하였다(ACSM, 2018).
5. 자료처리
본 연구의 자료 분석을 위해 SPSS WIN 23.0 프로그램을 사용하였으며, 측정요인들에 대한 평균과 표준편차를 산출하였다. 연령에 따른 신체구성, 심폐체력 및 텔로미어 길이의 차이를 알아보기 위해 일원변량분석(One-way ANOVA)을 실시하였다. 비만과 심폐체력 및 텔로미어 길이의 관련성은 피어슨 상관계수(Pearson correlation)를 이용하여 분석하였다. 사후검증은 Scheffe를 이용하였으며, 모두 유의수준 ɑ=.05에서 검증하였다.
Ⅲ. 결과
1. 연령에 따른 비교
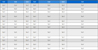
연령에 따른 신체구성의 차이는 <표 1>과 같다. 체질량지수, 근육량, 체지방률 및 허리둘레가 연령에 따른 유의한 차이를 나타냈다(p<.001). 사후검증 결과, 체질량지수는 10대와 20대, 30대, 40대, 50대가 유의한 차이를 나타냈으며(p<.001), 20대가 30대(p<.05), 40대, 50대(p<.001)와 유의한 차이를 나타냈다. 근육량은 10대와 20대가 30대(p<.01), 40대, 50대(p<.001)와 유의한 차이를 나타냈다. 체지방율은 10대와 20대(p<.05), 30대, 40대, 50대(p<.001)가 유의한 차이를 나타냈고, 20대가 30대, 40대(p<.01), 50대(p<.001)와 유의한 차이를 나타냈다. 허리둘레는 10대와 30대, 40대, 50대가 유의한 차이를 나타내었으며(p<.001), 20대와 30대, 40대(p<.01), 50대(p<.001)가 유의한 차이를 나타내었다.
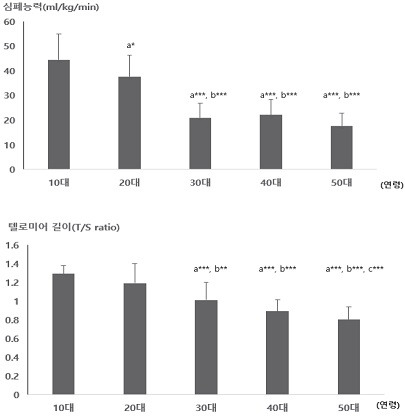
대상자들의 연령에 따른 심폐능력과 텔로미어 길이는 <그림 1>과 같다. 심폐능력은 10대가 20대(p<.05), 30대, 40대, 50대(p<.001)와 유의한 차이를 나타냈으며, 20대가 30대, 40대, 50대와 유의한 차이를 나타냈다(p<.001). 텔로미어 길이는 10대가 30대, 40대, 50대와 유의한 차이를 나타냈으며(p<.001), 20대가 30대(p<.01), 40대, 50대(p<.001)와 유의한 차이를 나타냈고, 30대가 50대와 유의한 차이를 나타냈다(p<.001).
2. 관련성 분석
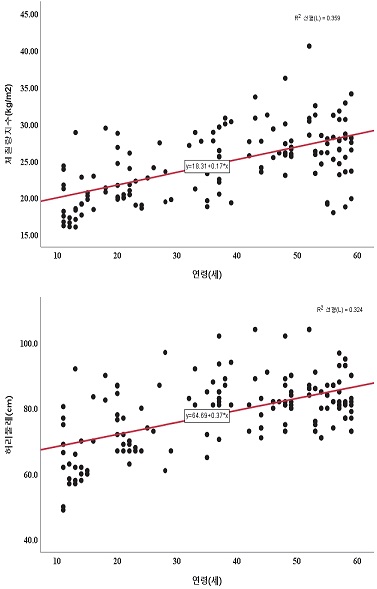
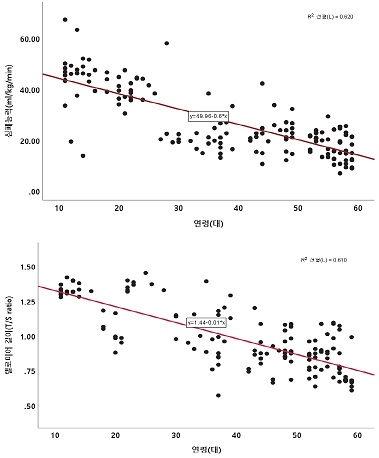
연령과 비만과의 관련성은 <그림 2>와 같다. 연령은 체질량지수(r=.599, p<.001) 및 허리둘레(r=.569, p<.001)과 유의한 양의 관련성을 나타내었다. 연령과 심페능력 및 텔로미어 길이의 관련성은 <그림 3>과 같다. 연령은 심폐능력(r=-.787, p<.001) 및 텔로미어 길이(r=-.781, p<.001)와 유의한 음의 관련성을 나타내었다.
연령별 비만, 심폐체력 및 텔로미어 길이와의 관련성은 <표 2>와 같다. 10대(p<.05), 20대(p<.01) 및 40대(p<.05)는 텔로미어 길이와 허리둘레가 유의한 음의 관련성을 나타내었다. 심폐체력과 텔로미어 길이는 40대에서 유의한 양의 관련성을 나타내었다(p<.01). 또한 전체 모든 연령을 대상으로 분석한 결과 텔로미어 길이는 체질량지수, 허리둘레와 유의한 음의 관련성을 나타내고(p<.001), 심폐체력과 유의한 양의 관련성을 나타내었다(p<.001).
Ⅳ. 논의
텔로미어는 세포주기마다 10bp정도 짧아지며(Lansdrop, 2005), 세포분열이 있을 때마다 텔로미어의 일정 부분이 복제되지 못하여 50~200의 DNA 뉴글레오티드가 소실되어 길이가 점차 감소된다(Counter, Avilion, LeFeuvre, Stewart, Greider, Harley et a., 1992: Harley, Futcher, & Greider, 1990). 텔로미어의 감소 비율은 성별에 따라 차이가 나타나는데, 남성은 매년 14.1bp가 감소하고 여성은 9.6bp가 감소하는 것으로 보고된다(d'Adda di Fagagna, Reaper, Clay-Farrace, Fiegler, Carr, Von Zglinicki et al., 2003). 점차적인 텔로미어 감손은 염색체 말단이 더 이상 보호받지 못하고 염색체의 불안정과 융합 및 세포의 죽음(apotosis)을 유도하는 것을 의미한다(Blackburn, 2001; McEachern, Krauskof, & Blackburn, 2000). 따라서, 말초혈액의 짧은 텔로미어 길이는 높은 사망률과 관련성이 있고(Steenstrups, Kark, Verhulst, Thinggaard, Hjelmborg, Dalgård et al., 2017), 암을 제외한 모든 사망률과 관련성이 높은 것으로 보고되었다(Rode, Nordestgaard, & Bojesen, 2015).
이 연구에서도 연령이 증가함에 따라 텔로미어 길이는 10대에 1.29±0.01 T/S ratio에서 20대에 1.19±0.21 T/S ratio, 30대에 1.01±0.19 T/S ratio, 40대에 0.89±0.12 T/S ratio, 50대에 0.8±0.14 T/S ratio로 점차적으로 감소하는 것으로 나타났으며, 10대와 20대는 유의한 차이가 없었지만, 30대부터는 10대와 20대와 유의한 차이를 보여 선행연구와 일치하는 결과를 나타내었다.
텔로미어는 염증과 산화스트레스에 영향을 받는데(Wolkowitz, Mellon, Epel, Lin, Dhabhar, Reus et al., 2011), 만성적인 염증은 백혈구의 교체를 증가시킴으로서 텔로미어 감손을 촉진시키고(Samani, Boultby, Butler, Thompson, & Goodall, 2001), 산화스트레스는 텔로미어를 합성하여 길이를 유지하는 기능을 담당하는 종합효소의 활성을 감소시켜 세포 복제 시 텔로미어 감손을 촉진시키게 된다(Kurz, Decary, Hong, Trivier, Akhmedov, & Erusalimsky, 2004). 따라서 비만이 산화스트레스를 증가시키고 만성적인 염증상태를 나타내기 때문에 텔로미어 길이 감소와 관련이 있을 것으로 제시되었다(Nordfjal et al., 2008).
체질량지수, 체지방율 및 허리둘레가 텔로미어 길이와 역의 관련성을 가지는 것으로 보고되었으며(Cui, Gao, Cai, Qu, Cai, Li et al., 2013), 복부지방조직은 직접적으로 텔로미어 감소와 관련이 있고 노화과정을 촉진시키는 것으로 보고되었다(Moreno-Navarrete, Ortega, Sabater, Ricart, & Fernández-Real, 2010). 이 연구에서도 텔로미어 길이는 정상체중의 경우 1.12±0.18 T/S ratio인데 비하여 과체중의 경우 0.93±0.23 T/S ratio, 비만인 경우 0.87±0.17 T/S ratio로 나타나 비만이 증가함에 따라 짧아지는 것으로 나타났다. 특히, 체중의 증가와 비만은 나이와 상관없이 텔로미어 감손을 촉진시키는 것으로 보고되는데(Gardner, Li, Srinivasan, Chen, Kimura, Lu et al., 2005), 18세 이후부터 빠른 체중의 증가는 텔로미어 감손을 촉진시키며, 50세 이후의 체중증가가 15% 이상인 경우 텔로미어 길이가 짧아지는 것으로 보고되었다. 이 연구에서 전체 모든 연령을 대상으로 분석한 결과 텔로미어 길이는 체질량지수, 허리둘레와 유의한 음의 관련성을 나타내었고(p<.001), 연령대별로 분석한 결과에서는 10대, 20대 및 40대에서 비만 지표 중 허리둘레와 텔로미어 길이가 음의 관련성을 나타내었다. 따라서 젊은 시기의 비만의 증가가 텔로미어 길이에 영향을 주고 중년이후에도 지속적으로 영향을 주는 것을 확인할 수 있었다.
심폐체력과 텔로미어의 관련성에 관한 연구들은 최대산소섭취량과 텔로미어 길이는 유의한 양의 관련성이 있는 것으로 보고되었다(Krauss, Farzaneh-Far, Puterman, Na, Lin, Epel et al., 2011; Mason, Risques, Xiao, Duggan, Imayama, Campbell, Kong et al., 2013). 이 연구에서 연령증가에 따라 심폐체력이 유의하게 감소하는 것으로 나타났으며, 심폐체력은 10대가 20대(p<.05), 30대, 40대, 50대(p<.001)와 유의한 차이를 나타내고, 20대가 30대, 40대, 50대와 유의한 차이를 나타내었다(p<.001). 또한, 심폐체력은 텔로미어 길이와 유의한 양의 관련성을 나타내었다(p<.001). 또한, 연령대별로 분석한 결과 텔로미어 길이는 40대에서 유의한 양의 관련성을 나타내었다(p<.01). 이와 같이 젊은집단에서 심폐체력과 텔로미어 길이의 관련성이 나타나지 않는 것은 텔로미어 길이가 손상을 받을 정도의 노화나 질병이 진행된 상태가 아니기 때문으로 제시되었다(LaRocca et al., 2010). 즉, 텔로미어 길이는 노화와 같이 감소하므로 중년 이후의 규칙적인 운동을 통한 심폐체력의 관리와 유지가 중년 이후의 텔로미어 길이 변화에 영향을 미칠 수 있다고 제시되었다. 이 연구에서도 40대에 심폐체력이 10~20대와 유의한 차이를 나타내고 심폐체력의 증가가 텔로미어 길이에 영향을 주는 것으로 나타나 선행연구와 유사한 결과를 나타내었으며, 중년 이후의 심폐체력의 관리가 중요함을 나타낸 결과로 생각된다.
Ⅳ. 결론
이 연구에서 연령에 따라 비만, 심폐체력, 텔로미어 길이는 유의한 차이를 나타냈으며, 연령은 비만, 심폐체력 및 텔로미어 길이와 유의한 관련성이 있는 것으로 나타났다. 연령대별로 비만과 심폐체력이 텔로미어 길이에 미치는 영향을 분석한 결과에서는 비만 지표 중 허리둘레가 젊은 시기와 중년시기 텔로미어 길이에 영향을 주는 것으로 나타났으며, 40대의 심폐체력 증가는 텔로미어 감손을 예방하는 것으로 나타났다.
이 연구는 여성들만을 대상으로 실시되었으며, 173명의 많지 않은 인원이었기 때문에 제한점이 있으나, 10대부터 50대까지의 연령을 대상으로 직접적으로 심폐체력을 측정하고 세포 노화의 지표인 텔로미어 길이를 측정하여 분석한 연구로 가치가 있다. 또한, 한국 젊은 여성들의 비만율이 낮은 수준임에도 불구하고, 젊은 시기부터 비만이 세포 노화의 지표인 텔로미어 길이에 영향을 주고, 중년 시기의 심폐체력의 관리가 중요하다는 결과를 나타냈다. 따라서, 젊은 시기부터 비만을 잘 관리하는 것과 중년 이후의 심폐체력을 관리하는 것이 연령 증가에 텔로미어의 감손을 방지하고 세포 노화를 예방하는 방법이 될 것으로 제시하는 바이다.
Acknowledgments
이 연구는 2020학년도 단국대학교 대학연구비 지원으로 연구되었음
참고문헌
- 대한비만학회(2020). Obesity Fact sheet. https://www.kosso.or.kr/file/2020_Obesity_Fact_Sheet_web.pdf
- American College of Sports Medicine (2018). ACSM’s guidelines for exercise testing and prescription. Wolters Kluwer Health Inc. USA.
-
Al-Attas, O. S., Al-Daghri, N. M., Alokail, M. S., Alfadda, A., Bamakhramah, A., Sabico, S., Pritlove, A., Harte, A., Tripathi, G., McTernan, P. G., Kumar, S., & Chrousos, G. (2010). Adiposity and insulin resistance correlate with telomere length in middle-aged Arabs: the influence of circulating adiponectin. European Journal of Endocrinology, 163, 601-607.
[https://doi.org/10.1530/EJE-10-0241]

-
Aviv, A., Valdes, A., Gardner, J. P., Swaminathan, R., Kimura, M., & Spector, T. D. (2006). Menopause modifies the association of leukocyte telomere length with insulin resistance and inflammation. The Journal of Clinical Endocrinology & Metabolism, 91, 635-640.
[https://doi.org/10.1210/jc.2005-1814]

-
Batsis, J. A., Mackenzie, T. A., Vasquez, E., Germain, C. M., Emeny, R. T., Rippberger, P., Lopez-Jimenez, F., & Bartels, S. J. (2018). Association of adiposity, telomere length and mortality: data from the NHANES 1999-2002. International Journal of Obesity, 42(2), 198-204.
[https://doi.org/10.1038/ijo.2017.202]

-
Bekaert, S., De Meyer, T., Rietzschel, E. R., De Buyzere, M. L., De Bacquer, D., Langlois, M., Segers, P., Cooman, L., Van Damme, P., Cassiman, P., Van Criekinge, W., Verdonck, P., De Backer, G. G., Gillebert, T. C., & Van Oostveldt, P. (2007). Telomere length and cardiovascular risk factors in a middle-aged population free of overt cardiovascular disease. Aging Cell, 6, 639-647.
[https://doi.org/10.1111/j.1474-9726.2007.00321.x]

-
Blackburn, E. H. (2001). Switching and signaling at the telomere. Cell, 106, 661-673.
[https://doi.org/10.1016/S0092-8674(01)00492-5]

-
Bischoff, C., Petersen, H. C., Graakjaer, J., Andersen-Ranberg, K., Vaupel, J. W., Bohr, V. A., Kolvraa, S., & Christensen, K. (2006). No association between telomere length and survival among the elderly and oldest old. Epidemiology, 17, 190-194.
[https://doi.org/10.1097/01.ede.0000199436.55248.10]

-
Cawthon, R. M., Smith, K. R., O'Brien, E., Sivatchenko, A., & Kerber, R. A. (2003). Association between telomere length in blood and mortality in people aged 60 years or older. Lancet, 361, 393-395.
[https://doi.org/10.1016/S0140-6736(03)12384-7]

-
Diaz, V. A., Mainous, A. G., Playe, M. S., & Everett, C. J. (2011). Telomere length and adiposity in a racially diverse sample. International Journal of Obesity, 34, 261-265.
[https://doi.org/10.1038/ijo.2009.198]

-
Counter, C. M., Avilion, A. A., LeFeuvre, C. E., Stewart, N. G., Greider, C. W., Harley, C. B., & Bacchetti, S. (1992). Telomere shortening associated with chromosome instability is arrested in immortal cells which express telomerase activity. The EMBO Journal, 11, 1921-1929.
[https://doi.org/10.1002/j.1460-2075.1992.tb05245.x]

-
Cui, Y., Gao, Y. T., Cai, Q., Qu, S., Cai, H., Li, H. L., Wu, J. W., Ji, B. T., Yang, G., Chow, W. H., Shu, X. O., & Zheng, W. (2013). Associations of leukocyte telomere length with body anthropometric indices and weight change in Chinese women. Obesity, 21(1), 2582-2588.
[https://doi.org/10.1002/oby.20321]

-
d'Adda di Fagagna, F., Reaper, P. M., Clay-Farrace, L., Fiegler, H., Carr, P., Von Zglinicki, T., Saretzki, G., Carter, N. P., & Jackson, S. P. (2003). A DNA damage checkpoint response in telomere-initiated senescence. Nature, 13;426(6963), 194-198.
[https://doi.org/10.1038/nature02118]

-
Denham, J., Nelson, C. P., O'Brien, B. J., Nankervis, S. A., Denniff, M., Harvey, J. T., Marquews, F. Z., Codd, V., Zukowaska-Szcechpwska, E., Samani, N. J., Tomaszewski, M., & Charchar, F. J. (2013). Longer leukocyte telomeres are associated with ultra-endurance exercise independent of cardiovascular risk factors. PLoS One, 31;8(7), e69377.
[https://doi.org/10.1371/journal.pone.0069377]

-
De Meyer, T., Rietzschel, E. R., De Buyzere, M. L., Van Criekinge, W., & Bekaert, S. (2011). Telomere length and cardiovascular aging: the means to the ends? Aging Research Reviews, 10(2), 297-303.
[https://doi.org/10.1016/j.arr.2010.11.001]

-
Du, M., Prescott, J., Kraft, P., Han, J., Giovannucci, E., Hankinson, S., & Vivo, I. D. (2012). Physical activity, sedentary behavior, and leukocyte telomere length in women. American Journal of Epidemiology, 75(5), 414-422.
[https://doi.org/10.1093/aje/kwr330]

-
Furukawa, S., Fujita, T., Shimabukuro, M., Iwaki, M., Yamada, Y., Nakajima, Y., Nakayama, O., Makishima, M., Matsuda, M., & Shimomura, I. (2004). Increased oxidative stress in obesity and its impact on metabolic syndrome. Journal of Clinical Investment, 114(12), 1752-1761.
[https://doi.org/10.1172/JCI21625]

-
Gardner, J. P., Li, S., Srinivasan, S. R., Chen, W., Kimura, M., Lu, X., Berenson, G. S., & Aviv, A. (2005). Rise in insulin resistance is associated with escalated telomere attrition. Circulation, 111, 2171-2177.
[https://doi.org/10.1161/01.CIR.0000163550.70487.0B]

-
Greenberg, A. S., & Obin, M. S. (2006). Obesity and the role of adipose tissue in inflammation and metabolism. American Journal of Clinical Nutrition, 83, 461S-465S.
[https://doi.org/10.1093/ajcn/83.2.461S]

-
Harley, C. B., Futcher, A. B., & Greider, C. W. (1990). Telomeres shorten during aging of human fibroblasts. Nature, 345, 458-460.
[https://doi.org/10.1038/345458a0]

-
Hotamisligil, G. S. (2006). Inflammation and metabolic disorders. Nature, 444, 860-867.
[https://doi.org/10.1038/nature05485]

-
Kim, S., Parks, C. G., DeRoo, L. A., Chen, H., Taylor, J. A., Cawthon, R. M., & Sandler, D. P. (2009). Obesity and weight gain in adulthood and telomere length. Cancer Epidemiology, Biomarkers & Prevention, 18(3), 816-820.
[https://doi.org/10.1158/1055-9965.EPI-08-0935]

-
Kurz, D. J., Decary, S., Hong, Y., Trivier, E., Akhmedov, A., & Erusalimsky, J. D. (2004). Chronic oxidative stress compromises telomere integrity and accelerates the onset of senescence in human endothelial cells. Journal of Cell Science, 1(117), 2417-2426.
[https://doi.org/10.1242/jcs.01097]

-
Krauss, J., Farzaneh-Far, R., Puterman, E., Na, B., Lin, J., Epel, E., Blackburn, E., & Whooley, M. A. (2011). Physical fitness and telomere length in patients with coronary heart disease: findings from the Heart and Soul Study. PLoS One, 6(11), e26983.
[https://doi.org/10.1371/journal.pone.0026983]

-
Lansdrop, P. M. (2005). Major cutbacks at chromosome ends. Trends in Biochemistry Science, 30, 388-395.
[https://doi.org/10.1016/j.tibs.2005.05.004]

-
LaRocca, T. J., Seals, D. R., & Pierce, G. L. (2010). Leukocyte telomere length is preserved with aging in endurance exercise-trained adults and related to maximal aerobic capacity. Mechanical Ageing & Development, 131(2), 165-167.
[https://doi.org/10.1016/j.mad.2009.12.009]

-
Lee, M., Martin, H., Firpo, M. A., & Demerath, E. W. (2011). Inverse association between adiposity and telomere length: The Fels Longitudinal Study. American Journal of Human Biology, 23, 100-106.
[https://doi.org/10.1002/ajhb.21109]

-
Mason, C., Risques, R. A., Xiao, L., Duggan, C. R., Imayama, I., Campbell, K. L., Kong, A., Foster-Schubert, K. E., Wang, C. Y., Alfano, C. M., Blackburn, G. L., Rabinovitch, P. S., & McTiernan, A. (2013). Independent and combined effects of dietary weight loss and exercise on leukocyte telomere length in postmenopausal women. Obesity, 21(12), E549-554.
[https://doi.org/10.1002/oby.20509]

-
Mather, K. A., Jorm, A. F., Parslow, R. A., & Christensen, H. (2011). Is telomere length a biomarker of aging? A review. The Journals of Gerontology, Series A: Biological Sciences, 66(2), 202-213.
[https://doi.org/10.1093/gerona/glq180]

-
Mathur, S., Ardestani, A., Parker, B., Cappizzi, J., Polk, D., & Thompson, P. D. (2013). Telomere length and cardiorespiratory fitness in marathon runners. Journal of Investigated Medicine, 61(3), 613-615.
[https://doi.org/10.2310/JIM.0b013e3182814cc2]

-
McEachern, M. J., Krauskof, A., & Blackburn, E. H. (2000). Telomere and their control. Annual Review of Genetics, 34, 331-358.
[https://doi.org/10.1146/annurev.genet.34.1.331]

-
Moreno-Navarrete, J. M., Ortega, F., Sabater, M., Ricart, W., & Fernández-Real, J. M. (2010). Telomere length of subcutaneous adipose tissue cells is shorter in obese and formerly obese subjects. International Journal of Obesity Related Metabolism Disorder, 34, 1345-1548.
[https://doi.org/10.1038/ijo.2010.49]

-
Müezzinler, A., Zaineddin, A. K., & Brenner, H. (2014). Body mass index and leukocyte telomere length in adults: a systematic review and meta-analysis. Obesity Review, 15(3), 192-201.
[https://doi.org/10.1111/obr.12126]

-
Njajou, O. R., Cawton, R. M., Blackburn, E. H., Harris, T. B., Li, R., Sanders, J. L., Newman, A. B., Nalls, M., Cummings, S. R., & Hsueh, W. C. (2012). Shorter telomeres are associated with obesity and weight gain in the elderly. International Journal of Obesity, 12(36), 1176-1179.
[https://doi.org/10.1038/ijo.2011.196]

-
Nordfjäll, K., Eliasson, M., Stegmayr, B., Melander, O., Nilsson, P., & Roos, G. (2008). Telomere length is associated with obesity parameters but with a gender difference. Obesity, 16, 2682-2689.
[https://doi.org/10.1038/oby.2008.413]

-
Rode, L., Nordestgaard, B. G., & Bojesen, S. E. (2015). Peripheral blood leukocyte telomere length and mortality among 64,637 individuals from the general population. Journal of the National Cancer Institute, 10;107(6), 1070-1074.
[https://doi.org/10.1093/jnci/djv074]

-
Samani, N. J., Boultby, R., Butler, R., Thompson, J. R., & Goodall, A. H. (2001). Telomere shortening in atherosclerosis. Lancet, 11;358(9280), 472-473.
[https://doi.org/10.1016/S0140-6736(01)05633-1]

-
Steenstrup, T., Kark, J. D., Verhulst, S., Thinggaard, M., Hjelmborg, J. V. B., Dalgård, C., Kyvik, K. O., Christiansen, L., Mangino, M., Spector, T. D., Petersen, I., Kimura, M., Benetos, A., Labat, C., Sinnreich, R., Hwang, S. J., Levy, D., Hunt, S. C., Fitzpatrick, A. L., Chen, W., Berenson, G. S., Barbieri, M., Paolisso, G., Gadalla, S. M., Savage, S. A., Christensen, K., Yashin, A. I., Arbeev, K. G., & Aviv, A. (2017). Telomeres and the natural lifespan limit in humans. Aging, 9(4), 1130-1142.
[https://doi.org/10.18632/aging.101216]

-
Tzanetakou, I. P., Katsilambros, N. L., Benetos, A., Mikhailidis, D. P., & Perrea, D. N. (2012). "Is obesity linked to aging?" Adipose tissue and the role of telomeres. Ageing Research Review, 11, 220-229.
[https://doi.org/10.1016/j.arr.2011.12.003]

-
Wolkowitz, O. M., Mellon, S. H., Epel, E. S., Lin, J., Dhabhar, F. S., Reus, V. I., Rosser, R., Burke, H. M., Kupferman, E., Compagnone, M., Nelson, J. C., & Blackburn, E. H. (2011). Leukocyte telomere length in major depression: Correlations with chronicity, inflammation and oxidative stress- preliminary findings. PLoS ONE, 6, e17837.
[https://doi.org/10.1371/journal.pone.0017837]

-
Yeh, J. K., & Wang, C. Y. (2016). Telomeres and Telomerase in Cardiovascular Diseases. Genes, 7(58), 1-18.
[https://doi.org/10.3390/genes7090058]