맨손 근력운동이 노인여성의 염증성 사이토카인, 피브리노겐-알부민 비율 및 DHEA-s에 미치는 영향
초록
본 연구는 만 65~80세 노인여성을 대상으로 실시한 12주간의 맨손 근력운동 프로그램이 염증성 사이토카인, 피브리노겐-알부민 비율 및 DHEA-s에 미치는 영향을 구명하기 위하여 운동군 14명, 대조군 13명으로 구분하여 실시하였다. 맨손 근력운동은 주 3회, 회당 60분으로 구성하였다. 운동강도는 1-4주 RPE 12-13, 5-8주 RPE 13-14, 9-12주 RPE 14-15로 점증적으로 강도를 증가하였다. 운동 전·후의 항목별 상호작용 효과 검증을 위해 이원배치 반복측정 분산분석을 실시하였으며, 상호작용효과 검증을 위해 시기 간 대응표본 t-검정, 집단 간 독립표본 t-검정, 각 항목별 유의수준은 .05로 설정하여 분석하였다. 그 결과 IL-6, TNF-α에서 상호작용 효과가 나타났고, 대조군에서 IL-6의 유의한 증가와 운동군의 TNF-α가 유의하게 감소하였다. 알부민은 운동군이 유의하게 증가하고 피브리노겐-알부민의 비율은 상호작용 효과가 나타났다. DHEA-s의 상호작용 효과 나타났고 운동군에서 유의하게 증가하였으며 대조군에서 유의하게 감소하였다. 결론적으로 12주간 이루어진 맨손 근력운동은 TNF-α 수준의 감소와 알부민 증가, 피브리노겐-알부민 비율 감소 및 DHEA-s를 증가시킴으로써, 노인여성의 심혈관질환을 예방하는데 효과적인 운동이라고 사료된다.
Abstract
The purpose of this study was to investigate the effect of bare-hand exercise program for 12 weeks on inflammatory cytokine, fibrinogen-albumin ratio, and DHEA-s in elderly women who aged 65 to 80 years. The subjects were randomly assigned to a exercise group(EG, n=14) and a control group(CG, n=13). Utilizing bare-hand exercise for 60 minutes 3 times per week for 12 weeks at the following intensities: RPE 12-13 for 1–4 weeks, RPE 13-14 for 5–8 weeks, RPE 14-15 for 9–12 weeks. The test data was analyzed by two-way repeated measures ANOVA, paired t-test, independent t-test, and the alpha level of p<0.05 was set for all tests of significance. As a consequence IL-6 and TNF-α showed a interaction effects. IL-6 of CG was significantly higher than EG and TNF-α of EG was significantly decrease than CG, respectively. The results of the albumin showed a significantly increase in EG and fibrinogen-albumin ratio showed a interaction effects. The results of DHEA-s showed a interaction effects. Also EG was significantly increase and CG was significantly decrease. Therefore, 12 weeks of bare-hand exercise had a positive effect on inflammatory cytokine, fibrinogen-albumin ratio, and DHEA-s in elderly women.
Keywords:
bare-hand exercise, CVD, inflammatory cytokine, fibrinogen-albumin ratio, DHEA-s키워드:
맨손 근력운동, 심혈관질환, 염증성 사이토카인, 피브리노겐-알부민 비율, DHEA-sI. 서론
노화(aging)는 세포가 증식을 멈추고 기능 장애가 되는 상태로 근육, 뼈 및 심혈관계를 포함하는 다양한 조직에 영향을 미침으로써 심혈관질환, 암, 대사질환 등 여러 만성질환 발병의 주요 위험요소로 작용하여 노인의 신체기능 및 삶의 질을 감소시키고 사망률을 증가시킨다(Sato & Yanangita, 2019; Serino & Salazar, 2019).
노년기 신체에 나타나는 여러 기관 기능들의 퇴화로 인해 가장 문제가 되는 심혈관질환은 전 세계적으로 사망원인 1위를 차지하고 있는 질환으로 관상동맥심장질환, 뇌혈관질환, 말초동맥질환 등을 포괄한다(최종식, 박준영, 양대승, 2012; WHO, 2017). 이와 관련된 질환들은 심장을 비롯한 동 정맥, 모세혈관을 포함하여 혈액이 순환하는 모든 부위에 발생이 가능하다(김효정, 김창근, 2005). 즉, 심혈관계는 산소화된 혈액, 영양분 등을 신체 각 조직에 전달한다는 점에서 모든 유기체의 건강과 수명에 있어 필수적이기 때문에 질병의 예방을 위한 꾸준한 관리와 검사가 필요하다(North & Sinclair, 2012).
심혈관질환 위험요인으로는 비만, 운동 부족, 고혈당증 등 다양하지만, 그중 노화 과정에 따른 심혈관 구조 및 기능 변화와 높은 연관성을 가지고 있다(Lakatta & Levy, 2003). 특히 염증 및 혈중지질 수치 악화로 인해 혈관 내 혈전과 염증이 유발되어 발병한다(김찬회, 이중원, 박희영, 2014).
염증반응과 산화스트레스는 염증성 사이토카인 생산 및 유리지방산의 증가를 일으킴으로써 혈관 내막의 손상을 일으킨다(류소연 등, 2011). 실제로 60세 이상에서 염증성 환경으로의 전환이 나타남에 따라 IL-6, TNF-α 등 염증성 사이토카인의 발현이 증가하고 IL-4, IL-10과 같은 항염증성 사이토카인의 감소가 관찰된다(Zheng et al., 2013).
피브리노겐은 혈액의 점도를 결정하고 혈전 형성유발 및 동맥벽에 붙어 있는 벽재성 혈전(mural thrombus)의 전구체로 동맥경화와 혈전성 질환을 초래하며, IL-6와 정적인 연관성을 지닌다(Chrusciel, Goch, Banach, Mikhailidis, Rysz, & Goch, 2009; Saldanha, da Rocha Martinez, Margeotto, & Gasparoto, 2021).
그에 반해 알부민은 산화질소(nitric oxide)의 저장소 기능을 가지고(Fanali, di Masi, Trezza, Marino, Fasano, & Ascenzi, 2012), 그 밖에도 호르몬, 칼슘, 지방산 등 운송작용을 하는 단백질 수송체 역할과 미세혈관 보전 기능 및 항응고에 영향을 미치며, 염증에 따른 알부민의 수준 감소는 심혈관질환에 잠재적인 영향을 미친다(Boldt, 2010; Chien, Chen, Lin, & Yeh, 2017; Nicholson, Wolmarans, & Park, 2000).
최근 연구에 의하면 피브리노겐-알부민 비율(fibrinogen-albumin ratio; FAR)은 심혈관질환에 있어 피브리노겐과 알부민의 개별적인 사용보다 임상 결과와 더 강한 연관성을 보이는 것으로 나타났다(Celebi, Ozcan Celebi, Berkalp, & Amasyali, 2020; Karahan et al., 2016). FAR의 증가는 혈액농축(hemoconcentration)의 수준을 나타내고(Ozcan Cetin, Konte, & Temizhan, 2019), 심혈관질환(Li, Tang, Luo, Qin, Wang, & Yan, 2020), 암 발병과 예후를 쉽게 측정할 수 있는 새로운 염증 지수로 활용되고 있다(Xu et al., 2018).
DHEA-s(dehydroepiandrosterone-sulfate)는 콜레스테롤을 기반으로 부신피질(adrenal cortex)에서 합성되는 스테로이드 호르몬으로 연령 의존적 감소로 인해 노화 호르몬으로 익히 알려져 있다(Savineau, Marthan, & de la Roque, 2013). 특히 근력 및 보행속도 감소와 유의한 연관성이 있으며 안드로겐과 에스트로겐에 대한 프로 호르몬 역할을 하기에 수준 감소는 염증 및 내피 손상을 촉진한다(Shufelt et al., 2010; Stenholm et al., 2010).
심혈관질환 예방 및 개선을 위한 방법 중 비교적 경제적이고 실천 가능한 비약리학적 요법으로 운동이 강조된다(김기진, 2019). 산소와 기질을 운반하는 심혈관계의 작용은 지속적인 근육 활동에 필수적이기 때문에 심혈관계 및 혈류 개선에 효과적인 수단이 될 수 있다(서필선, 오봉석, 2019). 따라서 규칙적인 운동은 심혈관 염증 및 응고에 긍정적인 변화를 나타냄으로써 심장보호 효과는 물론 심혈관질환의 이환율 및 사망률의 1차 예방 역할을 할 수 있어 강조되고 있다(Lin et al., 2015).
특히 부하에 따른 골격근의 수의적인 움직임을 통해 근력 향상을 도모하는 저항운동은 심혈관질환 위험요인 개선에 효과적이다(박혁, 김대열, 2017; Carbone et al., 2020). 노인의 경우 노화로 인해 골격근량의 감소보다 근력의 감소가 빠르게 나타나기에 예방을 위해서는 근비대와 근력증가에 효과적인 저항운동이 적절할 것으로 생각된다. 그러나 노인들의 웨이트 기구 이용은 관절 손상과 같은 부상의 위험, 특정 장소로의 이동, 경제적 부담 등 실효성의 문제가 따른다(홍용, 2011). 대안적 운동방법으로 맨손 근력운동은 체중의 부하를 이용하여 체력수준이 낮은 노인에게 안전하고 실질적이며, 이는 머신을 이용한 트레이닝과 견주는 효과를 제공함과 동시에 신체적 기능과 근력 향상에 효과적인 것으로 나타난다(Kanda et al., 2018; Yamauchi, Nakayama, & Ishii, 2009).
이를 종합해 볼 때, 규칙적인 운동습관은 현대문명 발달에 따른 신체활동 부족과 심혈관질환 위험을 증가시키는 다양한 원인의 예방 및 개선에 도움을 줄 수 있을 것으로 생각된다. 따라서 본 연구는 노인여성을 대상으로 실시한 12주간의 맨손 근력운동이 염증성 사이토카인, 피브리노겐-알부민 비율 및 DHEA-s에 미치는 영향을 구명하고자 한다.
Ⅱ. 연구 방법
1. 연구대상
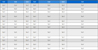
P대학 생명윤리위원회 승인 후, G시에 거주하는 65세 80세 이하의 노인여성을 대상으로 본 연구의 내용과 목적을 충분히 전달받은 뒤 자발적인 참여의사를 보인 자에게 실험동의서에 자필 서명을 받은 후 연구에 참여하도록 하였다(PNU IRB/2021_34_HR). 초기 연구대상자 모집은 총 30명으로 진행되었으나 탈락자 3명을 제외하여 최종적으로 운동군 14명, 대조군 13명의 결과를 분석하였다. 연구대상자의 신체적 특성은 <표 1>과 같다.
2. 측정항목 및 방법
모든 검사항목은 동일한 방법과 조건으로 IL-6, TNF-α, Fibrinogen, Albumin 및 DHEA-s에 대하여 사전, 사후 총 2회 실시하였다.
대상자들의 신장, 체중, 체지방량은 편안한 복장으로 신장계와 Inbody 430(Inbody, Korea)을 이용하여 측정하였다.
안정 시의 채혈은 8시간 이상 공복을 유지하여, 채혈 당일 오전 8-9시에 전완정맥에서 진공채혈관과 바늘을 이용하여 10 ml 혈액을 임상병리사가 채취하였다. 채취한 혈액은 SST와 Sodium citrate tube에 수집 후 원심분리기 Combi-514R(Hanil, Korea)로 10분간 3,000 rpm에서 원심 분리하여 상층액을 1.5 ml를 micro tube에 옮긴 다음 분석 전까지 –70℃ 이하에 보관하였다. IL-6와 TNF-α는 ELISA를 이용하여 분석하였으며, CymaxTM Human IL-6 ELISA(Abfrontier, KOR), CymaxTM Human TNF-α ELISA(Abfrontier, KOR)를 사용하였다. Fibrinogen는 clauss method를 이용하여 분석하였으며, STAⓇ-Liquid Fib(Stago, FRA), 분석 장비 STAGO(Stago, FRA)를 사용하였다. Albumin는 Colorimetric assay를 이용하여 분석하였으며, Clinimate ALB(Sekisui, JPN), 분석 장비 HITACHI 7600(Hitachi, JPN)를 사용하였다. DHEA-s는 ECLIA를 이용하여 분석하였으며, Elecsys DHEA-s(Roche, DEU), 분석 장비 Cobas 8000 e801(Roche, DEU)를 사용하였다.
FAR은 피브리노겐의 값에 알부민의 값을 나누는 공식계산을 통하여 나타내었다.
4. 자료처리
본 연구의 자료처리는 SPSS/PC+ version 21.0을 사용하여 측정항목에 대한 평균값(M)과 표준편차(SD)를 산출하고, 각 그룹 간 운동 실시 전·후의 항목별 상호작용 효과 검증을 위해 two-way repeated measures ANOVA를 실시하였다. 그룹 내 시기 간에는 paired t-test를 실시하였으며, 집단 간에는 independent t-test를 실시하였다. 통계적 유의수준은 .05로 설정하였다.
Ⅲ. 결과
1. 염증성 사이토카인
IL-6와 TNF-α에 대한 그룹 내, 그룹 간 변화와 상호작용을 비교·분석한 결과는 <표 3>과 같다. IL-6는 그룹, 시기 간 상호작용 효과가 나타났고(p<.01), 시기 간 주 효과가 나타났다(p<.001). 운동 전·후 시기 간 차이는 대조군이 유의하게 증가하였으며(p<.001), 그룹 간 차이는 운동 후(p<.05)와 변화량(p<.01)에서 유의한 차이가 나타났다. TNF-α는 그룹, 시기 간 상호작용 효과가 나타났고(p<.05), 운동 전·후 시기 간 차이에서 운동군이 유의하게 감소하였으며(p<.05), 그룹 간 차이는 운동 후와 변화량에서 유의한 차이가 나타났다(p<.05).
2. 피브리노겐-알부민 비율
피브리노겐-알부민 비율에 대한 그룹 내, 그룹 간 변화와 상호작용을 비교·분석한 결과는 <표 4>와 같다. 알부민은 운동 전·후 시기 간 차이에서 운동군이 유의하게 증가하였다(p<.05). 피브리노겐-알부민 비율은 그룹, 시기 간 상호작용 효과가 나타났으며(p<.05), 그룹 간 차이는 변화량에서 유의한 차이가 나타났다(p<.05).
Ⅳ. 논의
본 연구는 노인여성을 대상으로 심혈관질환 개선 및 예방의 효과를 알아보기 위해 12주간의 맨손 근력운동 실시하여 나타난 결과를 다음과 같이 논의하였다.
중년에서 노년으로 가는 일련의 노화 과정에 따라 전신 경도 염증은 꾸준히 증가하며(Trim, Turner, & Thompson, 2018), 광범위한 세포에서 생성되는 IL-6로 인한 간세포의 자극은 피브리노겐, CRP, serum amyloid A 등 급성기 단백질의 발현을 유도하고 알부민, 피브로넥틴의 생성을 감소한다(Tanaka, Narazaki, Ogata, & Kishimoto, 2014). 노화에 따라 증가한 TNF-α는 혈소판 과민성, 혈소판 전 응고 가능성 증가 및 혈전 형성을 유도하기에 충분한 것으로 보고된다(Davizon-Castillo et al., 2019). 또한, 고령인구 사망률과의 연관성은 노화에 의한 비정상적인 염증반응의 결과가 사이토카인의 변화와 관련이 있음을 알 수 있다(Bruunsgaard, Andersen-Ranberg, vB Hjelmborg, Pedersen, & Jeune, 2003; de Gonzalo-Calvo et al., 2010).
규칙적인 운동의 실천은 염증성 단핵구 수 감소(Timmerman, Flynn, Coen, Markofski, & Pence, 2008), Toll-like receptors(TLRs) 발현 감소(Carpenter, Strohacker, Breslin, Lowder, Agha, & McFarlin., 2012) 등을 통해 항염증 효과를 지니는 것으로 보고된다.
60~70세 여성을 대상으로 8주간 머신 저항운동을 실시한 결과 IL-6와 TNF-α의 수준이 유의하게 감소하였으며(Santiago et al., 2018), 좌식생활 노인여성에 비해 8개월간 저항운동을 수행한 노인여성의 IL-6와 TNF-α가 유의하게 감소한 것으로 나타났다(Cordova et al., 2011). 또한, 10주간 최대 8회 반복 저항운동을 실시한 노인여성의 TNF-α가 유의하게 감소하였다(Phillips, Flynn, McFarlin, Stewart, & Timmerman, 2010).
노인의 TNF-α 수준이 높을수록 악력 및 대퇴 근육의 감소와 관련이 있는 것으로 보고된다(Schaap et al., 2009). 그러나 골격근 수축에 따라 증가하는 PGC1-α는 골격근에서 염증성 사이토카인을 유도하는 활성산소를 억제하는 것으로 알려져 있으며, 그에 따라 지속적인 운동을 하는 사람일수록 전신 염증의 감소가 관찰된다(Handschin & Spiegelman, 2008). 본 연구의 경우 12주간 실시한 맨손 근력운동의 여러 동작을 통해 이루어진 반복적인 근수축이 근기능에 긍정적인 영향을 미침으로써 TNF-α의 유의한 감소에 기여한 것으로 사료된다. 이와 관련되어 TNF-α가 IL-6를 유도한다는 점을 감안할 때(Mathur & Pedersen, 2008), 대조군의 IL-6가 유의하게 증가한 것에 비해 운동군의 TNF-α 감소로 인해 IL-6의 증가 폭이 적은 것으로 추론된다.
이렇듯 맨손 근력운동을 통한 IL-6와 TNF-α의 긍정적인 변화는 노인여성의 염증 억제 및 감소시키고 나아가 심혈관질환 예방에 긍정적인 영향을 미칠 수 있음을 의미한다.
피브리노겐은 급성 염증 상태에서 적혈구 응집, 내피 세포층 무결성의 손상으로 이어지고 신체의 미세순환에 영향을 미친다(Lominadze, Dean, Tyagi, & Roberts, 2010). 특히 나이가 들수록 전체 단백질에서의 비율 증가 나타나며 내피세포 기능 평가를 위한 FMD(flow-mediated dilation; 혈류 매개성 혈관 확장)과 유의한 음의 연관성을 지녀 심혈관의 주요 위험요소로 보고된다(Clayton, Meade, Turner, & De Stavola, 2014; Ellins, Rees, Deanfield, Steptoe, & Halcox, 2017).
알부민은 생산량 감소 및 염증 상태에서 수치가 감소하여 음성 급성기 반응물로 알려져 있으며(Tanik et al., 2020), 나이가 듦에 따라 감소하고 남성보다 여성에서 낮게 나타난다(Arques, 2018). 노인의 경우 신장의 기능 이상으로 인하여 사구체 여과율 및 신장 혈류감소와 더불어 소변으로의 배출 증가가 나타난다(정해영 등, 2021).
그에 따라 새로운 염증 지표로서 FAR은 혈액의 유동학 및 염증에 대한 정보를 반영하는 혈청학적 마커로 혈전증 질환에 중요한 역할을 할 수 있다(Xiao, Jia, Wang, & Huang, 2019).
선행연구에 의하며 12주간 밴드운동을 실시한 노인여성의 피브리노겐 수치가 감소하는 경향을 보였고(김찬회, 이중원, 박희영, 2014), 노인여성의 12주간 걷기 및 밴드저항운동을 통해 운동군의 피브리노겐이 유의하게 감소하였으며, 대조군에서 알부민이 유의하게 감소하는 결과를 보였다(현수진, 하수민, 김정숙, 김도연, 2019). 또한, 노인여성을 대상으로 12주간 유산소 및 근력보강운동군으로 나누어 실시한 결과 근력보강운동군에서 알부민이 증가하는 경향을 보였다(조성봉, 2013).
높은 수준의 피브리노겐은 낮은 근력과 관련이 있으며(Tomey, Sowers, Zheng, & Jackson, 2009), 높은 신체활동량과 음의 관련성이 있는 것으로 보고된다(Gomez-Marcos et al., 2014). 나아가 반복적인 근 활동은 신체로의 혈류량을 증가시킴으로써 피브리노겐의 수준 감소에 영향을 미친 것으로 사료된다(Anton et al., 2006).
알부민은 혈액 순환과 간질액 사이에서 지속적으로 교환되기 때문에 알부민의 산화 환원 상태는 운동 후 전신 산화 환원 지표가 되며, 이는 골격근 발달에 대한 운동의 효과 유 무를 파악하는 데 도움이 될 수 있다(Wada, Takeda, & Kuwahata, 2018). 이는 본 연구에서 실시한 맨손 근력운동이 알부민 증가를 도모하는 데 적절하였다는 것을 뒷받침하며, 운동군의 TNF-α 감소 또한 알부민의 증가에 긍정적인 도움을 준 것으로 사료된다.
따라서 12주간의 규칙적인 맨손 근력운동은 피브리노겐의 과발현을 억제하고 혈관 기능에 긍정적인 영향을 미치는 알부민의 증가를 나타내며, 이들의 상호 관계를 반영한 심혈관질환의 새로운 예측 인자인 FAR 수준에 긍정적인 영향을 미침으로써 혈관 건강에 도움을 줄 수 있을 것으로 판단된다.
DHEA-s는 Cytochrome P450 스테로이드 생성 효소에 의해 부신에서 합성되는데, 실제로 CYP는 나이에 따라 농도와 활성도가 감소하는 것으로 알려져 있다(이준성, 2006; Nawata, Yanase, Goto, Okabe, & Ashida, 2002). 폐경 후 여성의 경우 폐경 전 여성에 비하여 근육 구성과 기능이 낮은데, DHEA-s 수준은 단면적 당 근력과 유의한 상관관계가 있는 것으로 보고된다(Pollanen et al., 2011). 그에 따라 좌업생활 보다 활동적인 생활습관을 가진 노인여성의 DHEA-s의 수치가 높은 것으로 보고된다(Frisoni, 2004).
12주간 탄성밴드운동을 실시한 노인여성의 DHEA-s가 향상되었으며(이향범, 김태상, 2018), 노인여성의 16주간 운동프로그램 후 유산소운동그룹보다 저항운동그룹의 DHEA-s 증가 폭이 높았다(조용찬, 한정규, 2007). 또한, 여성노인의 탄성밴드운동 실시 후 DHEA-s가 증가하였다(안나영, 김기진, 2018).
DHEA-s는 근력 감소, 보행속도 저하와 양적 관계를 지니는 호르몬으로 신체의 근 활동 활성과 근력증가는 감소한 DHEA-s 개선에 기여하는 것으로 보고된다(Stenholm et al., 2010). 또한, TNF-α는 DHEA 생성과정에 촉매작용을 하는 CYP17A1에 대한 억제작용을 통해 DHEA-s를 감소시켜 상관관계가 있는 것으로 보고된다(Izzicupo et al., 2013). 그에 따라 규칙적인 맨손 근력운동은 근 기능 활성과 근력 향상에 긍정적인 영향 및 염증성 사이토카인의 감소를 이루어냄으로써 DHEA-s 증가에 기여한 것으로 사료된다.
이를 종합해 볼 때, 규칙적인 맨손 근력운동의 중재는 노인여성의 IL-6 증가억제 및 TNF-α를 감소하고 알부민 증가 및 FAR의 수준을 감소하였으며, DEHA-s 증가를 도와 노인여성의 심혈관질환 예방 및 개선에 효과적인 것으로 사료된다.
Ⅳ. 결론
결론적으로 12주간의 맨손 근력운동이 신체적 기능 저하와 그로 인해 신체활동이 부족한 노인에게 심혈관질환 위험을 증가시킬 수 있는 염증성 사이토카인과 피브리노겐-알부민 비율의 감소 및 DHEA-s의 증가에 긍정적인 영향을 미침으로써 심혈관질환 예방에 효과적이며 건강한 삶을 유지하는 데 도움을 줄 수 있을 것으로 생각된다.
References
- 김기진(2019). 12주간의 복합운동이 대사증후군 동반 40대 비만여성의 경동맥 내중막 두께, 혈관기능관련 염증 유발요인 및 체력에 미치는 영향. 대한스포츠의학회지, 37(4), 184-194.
- 김찬회, 이중원, 박희영(2014). 요가운동과 밴드운동 수행이 노인여성의 염증지표 및 노화호르몬에 미치는 영향. 한국웰니스학회지, 9(2), 209-220.
- 김효정, 김창근(2005). 1년간의 운동 트레이닝이 중년 남성의 공복혈당장애 개선과 심혈관계 질환 위험 지표 및 유산소성 운동 능력에 미치는 영향. 운동과학, 14(2), 203-213.
- 류소연, 신민호, 이정애, 최진수, 박경수, 남해성, 정슬기, 권순석(2011). 지역사회 거주 50 세 이상 성인의 동맥경직도와 염증반응인자와의 관련성. 농촌의학·지역보건, 36(2), 101-112.
- 박혁, 김대열(2017). 탄성밴드 저항운동이 고령여성의 신체조성, 혈관탄성 및 낙상위험도지수에 미치는 영향. 한국산학기술학회 논문지, 18(3), 199-208.
- 서필선, 오봉석(2019). 라인댄스와 스트레칭 복합운동이 노인들의 대사증후군, 혈류동태 및 폐기능에 미치는 영향. 한국사회체육학회지, 75, 415-427.
- 안나영, 김기진(2018). 여성 노인의 탄성밴드 저항성 운동이 성호르몬, Dehydroepiandosterone-sulfate 농도와 보행능력에 미치는 영향. 코칭능력개발지, 20(2), 84-90.
- 이준성(2006). 노화된 간의 약물 대사에 미치는 영향. 대한내과학회지, 71(2), S848-S853.
- 이향범, 김태상(2018). 탄성밴드 트레이닝이 노인여성의 기능적 체력과 노화관련 호르몬에 미치는 영향. 한국웰니스학회지, 13(3), 629-637.
- 정해영, 김대현, 정희진, 방은진, 하수경, 노상균, 이지영, 유병팔(2021). 노화의 분자기전으로서 Senoinflammation. 대한노인재활의학회, 11(1), 1-17.
- 조성봉(2013). 여성노인의 근력보강운동이 혈청알부민, 백혈구 및 헤모글로빈에 미치는 영향. 한국체육과학회지, 22(4), 1075-1081.
- 조용찬, 한정규(2007). 유산소운동과 저항운동이 고령여성의 DHEA 및 Estrogen 호르몬에 미치는 영향. 한국체육과학회지, 16(3), 493-499.
- 최종식, 박준영, 양대승(2012). 노인여성의 12주간 유산소성 복합운동이 신체조성 및 혈관탄성에 미치는 영향. 한국체육과학회지, 21(3), 923-933.
- 현수진, 하수민, 김정숙, 김도연(2019). 복합운동프로그램이 여성노인의 심혈관질환 관련 염증인자에 미치는 영향. 한국여성체육학회지, 33(2), 153-167.
- 홍용(2011). 요가와 체중부하 저항 복합운동이 여성노인의 심혈관질환 위험요인과 인지기능에 미치는 영향. 한국체육과학회지, 20(3), 1421-1434.
-
Anton, M. M., Cortez-Cooper, M. Y., DeVan, A. E., Neidre, D. B., Cook, J. N., & Tanaka, H. (2006). Resistance training increases basal limb blood flow and vascular conductance in aging humans. Journal of Applied Physiology, 101(5), 1351-1355.
[https://doi.org/10.1152/japplphysiol.00497.2006]

-
Arques, S. (2018). Human serum albumin in cardiovascular diseases. European Journal of Internal Medicine, 52, 8-12.
[https://doi.org/10.1016/j.ejim.2018.04.014]

-
Boldt, J. (2010). Use of albumin: an update. British Journal of Anaesthesia, 104(3), 276-284.
[https://doi.org/10.1093/bja/aep393]

-
Bruunsgaard, H., Andersen-Ranberg, K., vB Hjelmborg, J., Pedersen, B. K., & Jeune, B. (2003). Elevated levels of tumor necrosis factor alpha and mortality in centenarians. The American Journal of Medicine, 115(4), 278-283.
[https://doi.org/10.1016/S0002-9343(03)00329-2]

-
Carbone, S., Kirkman, D. L., Garten, R. S., Rodriguez-Miguelez, P., Artero, E. G., Lee, D. C., & Lavie, C. J. (2020). Muscular strength and cardiovascular disease: an updated state-of-the-art narrative review. Journal of Cardiopulmonary Rehabilitation and Prevention, 40(5), 302-309.
[https://doi.org/10.1097/HCR.0000000000000525]

- Carpenter, K. C., Strohacker, K., Breslin, W. L., Lowder, T. W., Agha, N. H., & McFarlin, B. K. (2012). Effects of exercise on weight loss and monocytes in obese mice. Comparative Medicine, 62(1), 21-26.
-
Celebi, S., Ozcan Celebi, O., Berkalp, B., & Amasyali, B. (2020). The association between the fibrinogen-to-albumin ratio and coronary artery disease severity in patients with stable coronary artery disease. Coronary Artery Disease, 31(6), 512-517.
[https://doi.org/10.1097/MCA.0000000000000868]

-
Chien, S. C., Chen, C. Y., Lin, C. F., & Yeh, H. I. (2017). Critical appraisal of the role of serum albumin in cardiovascular disease. Biomarker Research, 5(1), 31.
[https://doi.org/10.1186/s40364-017-0111-x]

-
Chrusciel, P., Goch, A., Banach, M., Mikhailidis, D. P., Rysz, J., & Goch, J. H. (2009). Circadian changes in the hemostatic system in healthy men and patients with cardiovascular diseases. Medical Science Monitor, 15(10), 203-208.
[https://doi.org/10.12659/MSM.878203]

-
Clayton, T. C., Meade, T. W., Turner, E. L., & De Stavola, B. L. (2014). Peak flow rate and death due to coronary heart disease: 30-year results from the Northwick Park Heart cohort study. Open Heart, 1(1), e000164.
[https://doi.org/10.1136/openhrt-2014-000164]

-
Cordova, C., Lopes-e-Silva Jr, F., Pires, A. S., Souza, V. C., Brito, C. J., Moraes, C. F., Sposito, A. C., & Nobrega, O. T. (2011). Long-term resistance training is associated with reduced circulating levels of IL-6, IFN-gamma and TNF-alpha in elderly women. Neuroimmunomodulation, 18(3), 165-170.
[https://doi.org/10.1159/000323396]

-
Davizon-Castillo, P., McMahon, B., Aguila, S., Bark, D., Ashworth, K., Allawzi, A., Campbell, R. A., Montenont, E., Nemkov, T., D’Alessandro, A., Clendenen, N., Shih, L., Sanders, N. A., Higa, K., Cox, A., Padilla-Romo, Z., Hernandez, G., Wartchow, E., Trahan, G. D., Nozik-Grayck, E., Jones, K., Pietras, E. M., DeGregori, J., Rondina, M. T., & Di Paola, J. (2019). TNF-α–driven inflammation and mitochondrial dysfunction define the platelet hyperreactivity of aging. Blood, The Journal of the American Society of Hematology, 134(9), 727-740.
[https://doi.org/10.1182/blood.2019000200]

-
de Gonzalo-Calvo, D., Neitzert, K., Fernandez, M., Vega-Naredo, I., Caballero, B., Garcia-Macia, M., Suarez, F. M., Rodriguez-Colunga, M. J., Solano, J. J., & Coto-Montes, A. (2010). Differential inflammatory responses in aging and disease: TNF-α and IL-6 as possible biomarkers. Free Radical Biology and Medicine, 49(5), 733-737.
[https://doi.org/10.1016/j.freeradbiomed.2010.05.019]

-
Ellins, E. A., Rees, D. A., Deanfield, J. E., Steptoe, A., & Halcox, J. P. (2017). Increased fibrinogen responses to psychophysiological stress predict future endothelial dysfunction implications for cardiovascular disease?. Brain, Behavior, and Immunity, 60, 233-239.
[https://doi.org/10.1016/j.bbi.2016.10.017]

-
Fanali, G., di Masi, A., Trezza, V., Marino, M., Fasano, M., & Ascenzi, P. (2012). Human serum albumin: from bench to bedside. Molecular Aspects of Medicine, 33(3), 209-290.
[https://doi.org/10.1016/j.mam.2011.12.002]

-
Frisoni, G. B., Padovani, A., & Wahlund, L. O. (2004). The predementia diagnosis of Alzheimer disease. Alzheimer Disease & Associated Disorders, 18(2), 51-53.
[https://doi.org/10.1097/01.wad.0000126613.05674.0c]

-
Gomez-Marcos, M. A., Recio-Rodriguez, J. I., Patino-Alonso, M. C., Martinez-Vizcaino, V., Martin-Borras, C., de-la-Cal-Dela-Fuente, A., Sauras-Llera, I., Sanchez-Perez, A., Agudo-Conde, C., & Garcia-Ortiz, L. (2014). Relationship between physical activity and plasma fibrinogen concentrations in adults without chronic diseases. PloS one, 9(2), e87954.
[https://doi.org/10.1371/journal.pone.0087954]

-
Handschin, C., & Spiegelman, B. M. (2008). The role of exercise and PGC1α in inflammation and chronic disease. Nature, 454(7203), 463-469.
[https://doi.org/10.1038/nature07206]

-
Izzicupo, P., D’Amico, M. A., Bascelli, A., Di Fonso, A., D’Angelo, E., Di Blasio, A., Bucci, I., Napolitano,, G., Gallina, S., & Di Baldassarre, A. (2013). Walking training affects dehydroepiandrosterone sulfate and inflammation independent of changes in spontaneous physical activity. Menopause, 20(4), 455-463.
[https://doi.org/10.1097/gme.0b013e31827425c9]

-
Kanda, K., Yoda, T., Suzuki, H., Okabe, Y., Mori, Y., Yamasaki, K., Kitano, H., Kanda, A., & Hirao, T. (2018). Effects of low-intensity bodyweight training with slow movement on motor function in frail elderly patients: a prospective observational study. Environmental Health and Preventive Medicine, 23(1), 1-8.
[https://doi.org/10.1186/s12199-018-0693-4]

-
Karahan, O., Acet, H., Ertas, F., Tezcan, O., Caliskan, A., Demir, M., Kaya, A. F., Demirtas, S., Cevik, M. U., & Yavuz, C. (2016). The relationship between fibrinogen to albumin ratio and severity of coronary artery disease in patients with STEMI. The American Journal of Emergency Medicine, 34(6), 1037-1042.
[https://doi.org/10.1016/j.ajem.2016.03.003]

-
Lakatta, E. G., & Levy, D. (2003). Arterial and cardiac aging: major shareholders in cardiovascular disease enterprises: Part I: aging arteries: a “set up” for vascular disease. Circulation, 107(1), 139-146.
[https://doi.org/10.1161/01.CIR.0000048892.83521.58]

-
Li, M., Tang, C., Luo, E., Qin, Y., Wang, D., & Yan, G. (2020). Relation of fibrinogen-to-albumin ratio to severity of coronary artery disease and long-term prognosis in patients with non-st elevation acute coronary syndrome. BioMed Research International, 2020, 1-10.
[https://doi.org/10.1155/2020/1860268]

-
Lin, X., Zhang, X., Guo, J., Roberts, C. K., McKenzie, S., Wu, W. C., Liu, S., & Song, Y. (2015). Effects of exercise training on cardiorespiratory fitness and biomarkers of cardiometabolic health: a systematic review and meta‐analysis of randomized controlled trials. Journal of the American Heart Association, 4(7), e002014.
[https://doi.org/10.1161/JAHA.115.002014]

-
Lominadze, D., Dean, W. L., Tyagi, S. C., & Roberts, A. M. (2010). Mechanisms of fibrinogen‐induced microvascular dysfunction during cardiovascular disease. Acta physiologica, 198(1), 1-13.
[https://doi.org/10.1111/j.1748-1716.2009.02037.x]

-
Mathur, N., & Pedersen, B. K. (2008). Exercise as a mean to control low-grade systemic inflammation. Mediators of Inflammation, 2008, 1-6.
[https://doi.org/10.1155/2008/109502]

-
Nawata, H., Yanase, T., Goto, K., Okabe, T., & Ashida, K. (2002). Mechanism of action of anti-aging DHEA-S and the replacement of DHEA-S. Mechanisms of Ageing and Development, 123(8), 1101-1106.
[https://doi.org/10.1016/S0047-6374(01)00393-1]

-
Nicholson, J., Wolmarans, M., & Park, G. (2000). The role of albumin in critical illness. British Journal of Anaesthesia, 85(4), 599-610.
[https://doi.org/10.1093/bja/85.4.599]

-
North, B. J., & Sinclair, D. A. (2012). The intersection between aging and cardiovascular disease. Circulation Research, 110(8), 1097-1108.
[https://doi.org/10.1161/CIRCRESAHA.111.246876]

-
Ozcan Cetin, E. H., Konte, H. C., & Temizhan, A. (2019). Blood viscosity should not be overlooked when evaluating the fibrinogen to albumin ratio. Angiology, 70(5), 465-466.
[https://doi.org/10.1177/0003319718822244]

-
Phillips, M. D., Flynn, M. G., McFarlin, B. K., Stewart, L. K., & Timmerman, K. L. (2010). Resistance training at eight-repetition maximum reduces the inflammatory milieu in elderly women. Medicine and Science in Sports and Exercise, 42(2), 314-325.
[https://doi.org/10.1249/MSS.0b013e3181b11ab7]

-
Pollanen, E., Sipila, S., Alen, M., Ronkainen, P. H., Ankarberg‐Lindgren, C., Puolakka, J., & Kovanen, V. (2011). Differential influence of peripheral and systemic sex steroids on skeletal muscle quality in pre‐and postmenopausal women. Aging cell, 10(4), 650-660.
[https://doi.org/10.1111/j.1474-9726.2011.00701.x]

- Saldanha, A. L., da Rocha Martinez, T. L., Margeotto, A. P. P., & Gasparoto, A. L. V. (2021). Fibrinogen As a Cardiovascular Risk Marker. Journal of Internal Medicine and Cardiovascular Research, 1(1), 1-9.
-
Santiago, M. L. A., Neto, L. G. L., Borges Pereira, G., Leite, R. D., Mostarda, C. T., de Oliveira Brito Monzani, J., Sousa, W. R., Pinheiro, A. J. M. R., & Navarro, F. (2018). Effects of resistance training on immunoinflammatory response, TNF-alpha gene expression, and body composition in elderly women. Journal of Aging Research, 2018.
[https://doi.org/10.1155/2018/1467025]

-
Sato, Y., & Yanagita, M. (2019). The unprecedented era of aging. Inflammation and Regeneration, 39(15).
[https://doi.org/10.1186/s41232-019-0104-2]

-
Savineau, J. P., Marthan, R., & de la Roque, E. D. (2013). Role of DHEA in cardiovascular diseases. Biochemical Pharmacology, 85(6), 718-726.
[https://doi.org/10.1016/j.bcp.2012.12.004]

-
Schaap, L. A., Pluijm, S. M., Deeg, D. J., Harris, T. B., Kritchevsky, S. B., Newman, A. B., Colbert, L. H., Pahor, M., Rubin, S. M., Tylavsky, F. A., & Visser, M. (2009). Higher inflammatory marker levels in older persons: associations with 5-year change in muscle mass and muscle strength. Journals of Gerontology Series A, 64(11), 1183-1189.
[https://doi.org/10.1093/gerona/glp097]

-
Serino, A., & Salazar, G. (2019). Protective role of polyphenols against vascular inflammation, aging and cardiovascular disease. Nutrients, 11(1), 53.
[https://doi.org/10.3390/nu11010053]

-
Shufelt, C., Bretsky, P., Almeida, C. M., Johnson, B. D., Shaw, L. J., Azziz, R., Braunstein, G. D., Pepine, C. J., Bittner, V., Vido, D. A., Stanczyk, F. Z., & Bairey Merz, C. N. (2010). DHEA-S levels and cardiovascular disease mortality in postmenopausal women: results from the National Institutes of Health—National Heart, Lung, and Blood Institute (NHLBI)-sponsored Women’s Ischemia Syndrome Evaluation (WISE). The Journal of Clinical Endocrinology & Metabolism, 95(11), 4985-4992.
[https://doi.org/10.1210/jc.2010-0143]

-
Stenholm, S., Maggio, M., Lauretani, F., Bandinelli, S., Ceda, G. P., Di Iorio, A., Giallauria, F., Guralnik, J. M., & Ferrucci, L. (2010). Anabolic and catabolic biomarkers as predictors of muscle strength decline: the InCHIANTI study. Rejuvenation Research, 13(1), 3-11.
[https://doi.org/10.1089/rej.2009.0891]

-
Tanaka, T., Narazaki, M., Ogata, A., & Kishimoto, T. (2014). A new era for the treatment of inflammatory autoimmune diseases by interleukin-6 blockade strategy. In Seminars in Immunology, 26(1), 88-96.
[https://doi.org/10.1016/j.smim.2014.01.009]

-
Tanik, V. O., Cinar, T., Karabag, Y., Simsek, B., Burak, C., Cagdas, M., & Rencuzogullari, I. (2020). The prognostic value of the serum albumin level for long‐term prognosis in patients with acute pulmonary embolism. The Clinical Respiratory Journal, 14(6), 578-585.
[https://doi.org/10.1111/crj.13176]

-
Timmerman, K. L., Flynn, M. G., Coen, P. M., Markofski, M. M., & Pence, B. D. (2008). Exercise training‐induced lowering of inflammatory (CD14+ CD16+) monocytes: a role in the anti‐inflammatory influence of exercise?. Journal of Leukocyte Biology, 84(5), 1271-1278.
[https://doi.org/10.1189/jlb.0408244]

-
Tomey, K., Sowers, M., Zheng, H., & Jackson, E. A. (2009). Physical functioning related to C-reactive protein and fibrinogen levels in mid-life women. Experimental Gerontology, 44(12), 799-804.
[https://doi.org/10.1016/j.exger.2009.10.002]

-
Trim, W., Turner, J. E., & Thompson, D. (2018). Parallels in immunometabolic adipose tissue dysfunction with ageing and obesity. Frontiers in Immunology, 9, 169.
[https://doi.org/10.3389/fimmu.2018.00169]

-
Wada, Y., Takeda, Y., & Kuwahata, M. (2018). Potential role of amino acid/protein nutrition and exercise in serum albumin redox state. Nutrients, 10(1), 17.
[https://doi.org/10.3390/nu10010017]

- World Health Organization. (2017). Cardiovascular Diseases(CVDs).
-
Xiao, L., Jia, Y., Wang, X., & Huang, H. (2019). The impact of preoperative fibrinogen-albumin ratio on mortality in patients with acute ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention. Clinica Chimica Acta, 493, 8-13.
[https://doi.org/10.1016/j.cca.2019.02.018]

-
Xu, W. Y., Zhang, H. H., Xiong, J. P., Yang, X. B., Bai, Y., Lin, J. Z., Long, J. Y., Zheng, Y. C., Zhao, H. T., & Sang, X. T. (2018). Prognostic significance of the fibrinogen-to-albumin ratio in gallbladder cancer patients. World Journal of Gastroenterology, 24(29), 3281.
[https://doi.org/10.3748/wjg.v24.i29.3281]

-
Yamauchi, J., Nakayama, S., & Ishii, N. (2009). Effects of bodyweight‐based exercise training on muscle functions of leg multi‐joint movement in elderly individuals. Geriatrics & Gerontology International, 9(3), 262-269.
[https://doi.org/10.1111/j.1447-0594.2009.00530.x]

-
Zheng, M. M., Zhang, Z., Bemis, K., Belch, A. R., Pilarski, L. M., Shively, J. E., & Kirshner, J. (2013). The systemic cytokine environment is permanently altered in multiple myeloma. Plos one, 8(3), e58504.
[https://doi.org/10.1371/journal.pone.0058504]