복합운동이 폐경 후 비만 여성의 인슐린 저항성, 렙틴, GLP-1에 미치는 영향
초록
본 연구는 11주간의 복합운동이 인슐린 저항성, 렙틴, GLP-1에 미치는 영향을 구명하기 위하여 만 55세 이상 65세 미만의 폐경이 2년 이상 지난 비만 여성을 대상으로 운동군(n=12), 대조군(n=12)으로 구분하여 실시하였다. 트레드밀 걷기운동과 탄력밴드운동으로 구성된 복합운동은 11주간 주 3회, 1회당 60분으로 실시하였다. 트레드밀을 이용한 걷기운동 방법은 1-4주는 40-49%HRR, 5-8주는 50-59%HRR, 9-11주는 60-69%HRR로 실시하였다. 탄력밴드운동은 1-4주는 OMNI-RES 3-4의 저강도, 5-8주는 OMNI-RES 5-6의 중강도, 9-11주는 OMNI-RES 7-8의 고강도로 실시하였다. 측정 변인들에 대한 그룹 및 시기 간 상호작용을 검증하기 위하여 two-way repeated measures ANOVA로 처리하였고, 측정된 자료의 그룹 내 차이는 paired t-test, 그룹 간 차이는 independent t-test를 실시하였다. 통계적 유의수준은 .05로 설정하여 다음과 같은 결과를 얻었다. 인슐린 저항성에 대하여 글루코스, 인슐린, HOMA-IR은 그룹×시기 간 상호작용 효과가 나타났다. 운동 전·후 시기 간 차이에서 운동군이 11주 후 유의하게 감소하였으며 그룹 간 차이는 11주 후 변화량에서 유의한 차이가 나타났다. 또한, 렙틴은 그룹×시기 간 상호작용 효과가 나타났고, 운동 전·후 시기 간 차이에서 운동군이 11주 후 유의하게 감소하였으며 그룹 간 차이는 11주 후 변화량에서 유의한 차이가 나타났다. GLP-1은 그룹×시기 간 상호작용 효과가 나타났고, 시기 간 주효과가 나타났다. 운동 전·후 시기 간 차이에서 운동군이 11주 후 유의하게 감소하였으며 그룹 간 차이는 11주 후 변화량에서 유의한 차이가 나타났다. 이상의 결과를 종합해 볼 때 11주간의 트레드밀 걷기운동과 탄력밴드운동으로 구성된 복합운동이 폐경 후 비만 중년여성의 인슐린 저항성, 렙틴, GLP-1에 긍정적인 영향을 미친 것으로 사료 된다.
Abstract
The purpose of this study was to investigate the effect of combined exercise program for 11 weeks on insulin resistance, leptin, GLP-1 in post menopause obesity women, aged 55 to 65 years by dividing them into a exercise group(n=12) and control group(n=12). The combined exercise which was composed treadmill and elastic band conducted three times a week for 11 weeks for 60 minutes per session. The intensity of treadmill walking exercise was comprised at 40-49%HRR for 1-4 weeks, 50-59%HRR for 5-8 weeks, and 60-69%HRR for 9-11 weeks. Elastic band exercise were performed with a low intensity of OMNI-RES 3-4 at 1-4 weeks, a medium intensity of OMNI-RES 5-6 at 5-8 weeks, and a high intensity of OMNI-RES 7-8 at 9-11 weeks. Statistical analysis was utilized SPSS 22.0 and p.<05 value was used for significance. We used two-way repeated measures ANOVA to determine the interaction between groups and times. Also, the difference between the results of pre and post parameters was calculated by paired t-test in each groups and independent t-test was utilized for demonstrate the significant difference between exercise group and control group.
The results of the glucose, insulin, HOMA-IR showed a interactions between groups and times. The difference between the pre and post exercise periods was significant decreased in the exercise group, and showed significant difference in the amount of variation between groups after 11 weeks. The results of the leptin showed a interactions between groups and times. The difference between the pre and post exercise periods was significant decreased in the exercise group, and showed significant difference in the amount of variation between groups after 11 weeks. The results of the GLP-1 showed a interactions between groups and times. The difference between the pre and post exercise periods was significant decreased in the exercise group, and showed significant difference in the amount of variation between groups after 11 weeks. Therefore, it is concluded that 11 weeks of combined exercise including treadmill walking and elastic band exercise had a positive effect on insulin resistance, leptin, GLP-1 in post menopause obesity women.
Keywords:
Combined exercise, Postmenopause obesity women, Insulin resistance, Leptin, GLP-1키워드:
복합운동, 폐경 후 비만 여성, 인슐린 저항성, 렙틴I. 서론
현재 국내의 전체 인구 중 비만율은 33.8%이고, 특히, 여성의 비만은 연령이 증가할수록 증가하며 50대 29.6%, 60대 34.9%가 비만이다(보건복지부, 2019). 중년여성의 비만율은 폐경(menopause)으로 인한 에스트로겐(estrogen) 수치의 감소에 영향을 받는다(Ko & Kim, 2020). 에스트로겐 호르몬 중 에스트라디올(estradiol)은 여성의 신진대사와 체중조절을 돕는 역할을 하지만 폐경으로 인한 에스트라디올 호르몬 분비의 감소는 근육량의 감소와 지방 축적이 증가하게 되면서 체지방을 증가시킨다(Geraci et al., 2021; Lizcano & Guzman, 2014). 또한, 노화는 신체활동의 제한으로 에너지 소비량보다 음식 섭취량이 많아지면서 체내 에너지 불균형을 유발시켜 지방 조직이 과도하게 축적된다(Friedman, 2009). 이는 체지방의 증가 및 근력의 감소로 이어지게 되어 결국 비만을 유발한다(Goossens, 2017).
인슐린(insulin)은 체내에 포도당이 들어오게 되면 췌장의 β 세포에 자극을 주어 분비되어 근육 내로 포도당(glucose) 흡수를 촉진시키고, 간에서 포도당을 글리코겐(glycogen)으로 저장하여 혈당을 낮추는 역할을 한다(Newsholme & Krause, 2012). 하지만 비만이 되면 인슐린 수용체(insulin receptor)의 약화로 인해 GLUT4(glucose transporter type 4) 수준이 감소하여 근육 내에 포도당 흡수가 원활하지 못하게 된다(Czech, 2017). 이처럼 조직 내에 흡수되지 못하고, 체내에 유리된 포도당은 지방으로 변환되어 내장지방 형태로 저장되면서 혈중에 유리지방산(free fatty acid; FFA)을 증가시켜 인슐린 저항성이 일어나게 되는 원인이 된다(김정숙, 김도연 및 하수민, 2019). 인슐린 저항성은 체지방량 증가, 체중 증가, 서구화된 식습관, 운동 부족, 폐경 등의 이유로 증가된다(이주연 및 신상근, 2019). 특히, 폐경은 복부지방 및 내장지방의 증가와 근육의 감소가 나타날 수 있으며(한명석, 2011) 이는 비만을 쉽게 유발하여 탄수화물대사에 장애를 일으켜 체내에 흡수되어야 하는 혈당의 활용 능력을 감소시키게 되어 인슐린 저항성으로 이어지게 된다(이한, 2011). 비활동성으로 인한 복부 및 내장지방의 증가는 지방 세포의 수 및 크기를 증가시켜 체지방의 축적을 유발시키고, 이는 인슐린 저항성이 증가하여 비만, 대사질환 및 심혈관질환이 발병될 가능성을 높이게 되어 결국 건강에 위험이 발생한다(Kolb, Kempf, Rohling, & Martin, 2020; Roberts, Hevener, & Barnard, 2013).
지방 세포에서 생성되고 분비되는 렙틴(leptin)은 시상하부(hypothalamus) 수용체에서 작용하는 호르몬으로 에너지 소비를 자극하고, 음식 섭취를 감소시켜서 신체 내의 에너지 항상성을 유지하며 체지방량에 비례하여 생성되면서 정상인보다 비만인에 있어 많이 분비된다(Fairbrother, Kidd, Malagamuwa, & Walley, 2018; Queipo-Ortuno et al., 2013). 렙틴은 남성보다 여성에게서 높게 나타나고(Kasacka, Piotrowska, Niezgoda, & Lebkowski, 2019) 신체활동 감소는 체지방의 증가와 골격근 이상으로 비정상적인 아디포카인(adipokine) 분비를 촉진하며 렙틴의 수치를 증가시켜서 인슐린 저항성을 발생시키게 된다(Hong et al., 2007). 이로 인하여 높아진 혈중 인슐린 수치 및 렙틴 수용체의 저항성 증가는 렙틴과 인슐린이 공유하는 신호전달체계에서 렙틴이 뇌 시상하부에 전달하는 신호를 방해하여 비만을 비롯한 제2형 당뇨병과 심혈관질환을 발병시키기도 한다(Katsiki, Mikhailidis, & Banach, 2018; Konner & Bruning, 2012).
렙틴과 유사하게 식욕 억제의 기능을 하는 GLP-1(glucagon like peptide-1)은 인크레틴(incretin) 호르몬 중 하나로써 위장관 운동을 통해 공복감을 억제하여 식욕을 감소시키는 역할을 한다(신재숙, 2020). 또한, 음식 섭취로 췌장을 자극하여 인슐린 합성 및 분비를 촉진하고, 글루카곤(glucagon)의 분비를 억제하여 혈당의 농도를 감소시키는 작용을 한다(Smith, Hackett, Galli, & Flynn, 2019). 정상적인 GLP-1의 작용은 식후에 인슐린 분비를 촉진하여 체내의 근육, 간 및 췌장을 포함한 말초조직에 인슐린 감수성을 향상시킨다(Azuma et al., 2008). 하지만 비만인은 지방 세포의 증가로 췌장에 지방을 축적시켜 β 세포의 기능을 감소시키고, 손상된 β 세포는 GLP-1 분비 감소로 인슐린 분비에 부정적인 영향을 미치게 되어 혈당 조절에 어려움을 갖게 된다(Frasca et al., 2016; Lee & Jun, 2014).
여성은 연령이 증가하면서 노화로 인해 중년여성 이후 생식기능이 낮아지고 내분비계의 변화로 인해 심리적 및 사회적으로 변화가 일어나므로(이정화, 김경혜 및 김경덕, 2014) 정서적인 안정과 건강한 신체를 유지 및 증진하기 위해서 규칙적인 운동을 권장하고 있다(김도은, 2017; 신석민 및 김병수, 2015). 지속적이고 규칙적인 운동은 체지방 감소를 통해 내장지방의 감소를 유도하고, 인슐린 민감성을 증가시키며 체내에 포도당 합성 및 생성을 억제하여 혈당 수준을 낮출 수 있다(김현준 및 신재숙, 2021). 운동은 신체활동량을 증가시켜서 에너지 소비량의 증가와 에너지 항상성의 기능을 통해 렙틴의 분비를 감소시키게 되어 비만을 예방할 수 있다(Li, Kim, & Sim, 2020). 또한, 규칙적인 운동은 GLP-1을 증가시켜서 혈당 조절이 어려운 비만과 제2형 당뇨병 환자에게 중요한 역할을 하게 된다(Hamasaki, 2018).
복합운동은 신체활동이 저하된 비만에 있어 골격근과 근 기능의 향상으로 제지방량의 증가와 더불어 체지방 감소에 효과적이다(김원현 및 김승석, 2016). 유산소운동 중 걷기운동은 간단한 준비와 쉽게 접근할 수 있는 운동으로 신진대사의 활성화와 심폐 능력의 향상과 더불어 달리기 운동보다 골격근 및 관절에 충격이 덜할 수 있는 장점이 있는 운동이다(김철주 및 김현우, 2017). 또한, 체지방을 연소시키고, 지방 대사를 활성화하는 운동방법으로 대사질환의 예방에 도움을 준다(권정현, 2021).
한편, 상대적으로 근력과 관절가동범위가 낮은 중년여성에게 탄력밴드운동은 고중량의 웨이트 기구을 이용한 운동보다 신체에 부하를 덜어주어 신체의 안정성을 높이고, 부상을 예방할 수 있는 운동으로 제시하고 있다(위승준, 이병선 및 이만균, 2019). 또한, 단순하고 편리한 사용이 가능한 이점을 가진 탄력밴드운동은 다양한 각도와 동작으로 목표로 하는 근력 강화와 근지구력을 증가시키는데 도움을 준다(이영섭 및 곽종형, 2021; 한은상 및 서현, 2019).
이를 종합해볼 때 중년여성의 규칙적인 운동은 신체활동량의 증가, 신진대사 활성화 및 근 기능 향상과 같이 신체에 다양한 이점이 있음에도 불구하고, 운동을 통한 폐경 후 비만 중년여성의 인슐린 저항성, 렙틴, GLP-1과의 관계에 관한 연구는 미흡한 실정이다. 따라서 본 연구의 목적은 11주간 복합운동을 통하여 폐경 후 비만 중년여성의 인슐린 저항성, 렙틴, GLP-1에 미치는 영향에 대해 구명하고, 비만의 개선을 통해 대사질환 및 제2형 당뇨병을 예방하는데 있다.
Ⅱ. 연구 방법
1. 연구대상
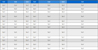
본 연구의 대상자는 B 광역시에 거주하고 있는 폐경이 2년 이상 지난 만 55세 이상 65세 미만의 비만 여성으로 BMI 25 kg/㎡, 체지방률 30% 이상을 충족한 대상으로 선정하였다(대한비만학회, 2020; 서정훈, 김동현, 박해용, 이승신 및 정지윤, 2016). 본 연구의 대상자 표본 수 산정을 위해 G*Power 3.1을 이용하여 이원 반복측정 분산분석법으로 effect size f=0.3, 검정력 0.7에 의거하여 분석한 결과 total sample size는 총 20명으로 산출되었고, 탈락률을 감안하여 총 26명으로 구성하였다. 이 중 개인 사정에 의한 중도 탈락자 2명을 제외한 운동군 12명, 대조군 12명으로 총 24명을 대상으로 분석하였다. 본 실험을 시작하기에 앞서 부산대학교 생명윤리위원회 승인(PUN IRB/2021_154_HR)을 받았으며 대상자들에게 본 연구의 목적과 취지를 충분히 설명한 뒤 자발적으로 참여할 의사를 보인 자에 한해서 실험동의서를 받아 참여하도록 하였다. 또한, 연구 대상자 개인의 전염성 질환, 근골격계 질환, 제2형 당뇨병 및 약물 복용자, 평소에 규칙적인 운동에 참여하는 자를 제외하여 선정하였다. 대상자의 신체적 특성은 <표 1>과 같다.
2. 측정항목 및 방법
모든 검사항목은 동일한 방법과 조건으로 인슐린 저항성, 렙틴, GLP-1에 대해 측정 전 8시간 이상 공복 상태를 유지하고, 측정 당일 오전 8-9시에 실시하였다. 운동군과 대조군에 대해서 사전, 사후 총 2회를 실시하였다.
본 연구 대상자들의 신장(cm)은 신장계를 이용하여 턱을 아래로 당겨 정면을 바라본 상태에서 발뒤꿈치부터 머리끝 지점까지의 높이를 측정하였으며 체중(kg), 체지방량(%), 골격근량(kg)의 측정을 위해 간편한 복장을 착용하고, 귀금속을 제거한 후 Inbody 430(Inbody, KOR)를 이용하여 자동으로 측정하였다.
혈액 검사를 위해 전날 오후 8시 이후부터 공복을 유지할 수 있도록 하였고, 채혈하는 당일 오전 8-9시에 진공채혈관(vacutainer)과 바늘(needle)을 이용하여 전완정맥에서 혈액 10 ㎖를 임상병리사가 직접 채취하였다. 채취한 혈액은 serum separate tube(SST)에 수집한 후에 원심분리기 Combi-514R(Hanil, KOR)을 이용하여 3000 rpm으로 20분간 분리한 후 serum을 분리한 다음 상층액을 1.5 ㎖ 튜브(micro tube)에 옮긴 다음 분석 시까지 –70℃에 보관하여 분석하였다. 글루코스의 분석방법은 UV assay(HK)를 이용하여 분석하였고, Glu kit(Roche, DEU)의 시약을 Hitachi 7600(Hitachi, JPN)의 장비를 사용하여 측정하였다. 인슐린의 분석방법은 ECLIA(electrochemiluminescence immunoassay)를 이용하여 분석하였고, Insulin kit(Roche, DEU)의 시약을 Cobas e801(Roche, DEU)의 장비를 사용하여 측정하였다. 렙틴의 분석방법은 방사면역측정법 ELISA(enzyme-linked immunosorbent assay)를 이용하여 분석하였고, QuantikineTM ELISA human leptin(R&D, USA)의 시약을 Spectra max 190(Molecular device, USA)의 장비를 사용하여 측정하였다. GLP-1의 분석방법 ELISA(enzyme-linked immunosorbent assay)를 이용하여 분석하였고, Human glucagon like peptide 1(Cusabio, USA)의 시약을 Spectra max 190(Molecular device, USA)의 장비를 사용하여 측정하였다.
HOMA-IR은 공복 인슐린과 공복 글루코스의 농도를 이용하여 인슐린 저항성과 췌장의 β 세포의 인슐린 분비기능을 추정하여 간접적으로 인슐린 저항성을 측정할 수 있는 일반적인 지표로 알려져 있으며 본 연구에서는 Homeostasis model assessment index=[fasting insulin(μU/mL)×fasting glucose(mg/dL)]/405의 공식으로 산출하였다(Matthews et al., 1985).
3. 복합운동프로그램
본 연구는 트레드밀 걷기운동과 탄력밴드운동으로 구성된 복합운동프로그램으로 11주간 주 3회 실시하였으며 1회 운동시간은 준비운동 10분, 걷기운동 20분, 탄력밴드 운동 20분, 정리운동 10분으로 총 60분간 진행되었다. 운동프로그램은 하수민, 김정숙, 하민성, 김보성 및 김도연(2019)의 복합운동 프로그램을 참고하여 수정, 보완하였다.
트레드밀(treadmill) 걷기 운동은 걷기부터 시작하여 빠른 걷기 수준으로 점진적인 형태로 강도를 높였으며 이는 무선 심박 수 측정기(polar)를 이용하여 목표 심박 수(THR)의 측정과 운동 자각도(RPE)를 설정하였다. 운동강도는 점증 부하 운동방법을 적용하여 1-4주는 예비심박수(HRR)의 40-49%HRR, 5-8주는 50-59%HRR, 9-11주는 60-69%HRR로 실시하였다(ACSM, 2018).
탄력밴드 저항성 운동은 10점 OMNI-저항운동척도를 사용하여 사전 검사(어깨 및 고관절 외전 15RM 수행할 때 고강도 그립 폭: 고강도, 고강도 수준의 그립 폭+25%: 중강도, 고강도 수준의 그립 폭의+50%: 저강도)를 실시한 후에 개인마다 운동강도를 설정하였다(Colado et al., 2012). 운동강도는 1-4주는 OMNI-RES 3-4의 저강도, 5-8주는 OMNI-RES 5-6의 중강도, 9-11주는 OMNI-RES 7-8의 고강도로 점증 부하 운동방법으로 실시하였다. ACSM(2018)의 저항성운동 가이드라인을 참고하여 근육별 운동 세트는 2회, 세트 당 12회를 반복하였고, Red 색상의 Thera-band(Theraband, USA)를 이용하였다. 본 연구의 구체적인 복합운동프로그램은 <표 2>와 같다.
4. 자료처리
본 연구에서 측정한 모든 자료는 SPSS ver 22.0을 이용하여 측정항목에 대한 집단별, 요인별 평균값(M)과 표준편차(SD)를 산출하였다. 집단 및 시기 간의 상호작용검증을 위해 two-way repeated measures ANOVA로 처리하였고, 집단 내 운동 전·후 차이 검정은 paired t-test, 집단 간 차이 검정은 independent t-test로 실시하였다. 각 항목별 통계적 유의수준은 .05로 설정하였다.
Ⅲ. 결과
1. 인슐린 저항성
글루코스에 대한 상호작용 효과 및 그룹 내, 그룹 간 변화를 분석한 결과는 <표 3> 에 나타난 바와 같다. 글루코스는 그룹×시기 간 상호작용 효과가 나타났다(p<.01). 운동 전·후 시기 간 차이에서 운동군이 유의하게 감소하였으며(p<.001) 대조군도 유의하게 감소하였다(p<.01). 그룹 간 차이는 11주 후 변화량(p<.01)에서 유의한 차이가 나타났다.
인슐린에 대한 상호작용 효과와 그룹 내, 그룹 간 변화를 분석한 결과는 <표 3>에 나타난 바와 같다. 인슐린은 그룹×시기 간 상호작용 효과가 나타났다(p<.01). 운동 전·후 시기 간 차이에서 운동군이 유의하게 감소하였다(p<.001). 그룹 간 차이는 11주 후 변화량(p<.01)에서 유의한 차이가 나타났다.
HOMA-IR에 대한 상호작용 효과와 그룹 내, 그룹 간 변화를 분석한 결과는 <표 3>에 나타난 바와 같다. HOMA-IR은 그룹×시기 간 상호작용 효과가 나타났다(p<.01). 운동 전·후 시기 간 차이에서 운동군이 유의하게 감소하였다(p<.001). 그룹 간 차이는 11주 후 변화량(p<.01)에서 유의한 차이가 나타났다.
2. 렙틴
렙틴에 대한 상호작용 효과와 그룹 내, 그룹 간 변화를 분석한 결과는 <표 4>에 나타난 바와 같다. 렙틴은 그룹×시기 간 상호작용 효과가 나타났고(p<.05), 운동 전·후 시기 간 차이에서 운동군이 유의하게 감소하였다(p<.05) 그룹 간 차이는 11주 후 변화량(p<.05)에서 유의한 차이가 나타났다.
Ⅳ. 논의
본 연구는 폐경 후 비만 중년여성을 대상으로 11주간 복합운동을 실시한 결과 운동 전, 후 시기 간 차이에서 글루코스, 인슐린, HOMA-IR의 수치가 운동군에서 유의하게 감소하였고, 대조군의 경우 유의한 차이가 없었다. 대조군의 경우 글루코스의 수치가 유의하게 감소하였지만 운동군이 대조군보다 더 유의하게 감소하였기에 운동이 글루코스의 수치에 긍정적인 영향을 주었다고 생각된다. 본 연구에서 운동군에서 HOMA-IR의 수치가 감소되어 개선을 보인 것은 규칙적인 운동이 체지방을 직접적으로 연소시키고, 지방 대사를 활성화하여 체조성을 긍정적으로 변화시키게 되어 인슐린 저항성의 개선에 영향을 주었을 것으로 판단된다(신덕수 등, 2013; 이향범, 정원정 및 권오석, 2018). 적절한 강도의 운동은 체중 감소와 더불어 글루코스 내성(glucose tolerance)에 크게 영향을 미치지 않고, 인슐린 농도를 감소시키며(이승범, 2014) 이는 포도당 수송이 요구되는 인슐린 수용체에 인슐린 작용을 높이게 되어 인슐린 감수성이 향상된 결과라 보여진다(강설중 및 정성림, 2010).
또한, 운동에 따른 인슐린 저항성의 선행연구 결과를 살펴보면 폐경 후 비만 중년여성을 대상으로 12주간 걷기운동이 체지방률을 감소시켜서 인슐린 저항성을 개선하였고(정현령, 류종우, 유동훈, 신영호 및 강호율, 2012), 비만 중년여성을 대상으로 12주간 빠른 걷기운동과 탄력밴드를 이용한 복합운동을 실시한 결과 인슐린, 글루코스의 감소가 인슐린 저항성에 긍정적인 영향을 주었다고 보고하였다(조재혁, 2016). 이러한 결과는 규칙적인 운동을 통하여 체지방 감소가 체내에 인슐린의 작용을 방해하는 유리지방산의 감소를 이끌어 당 대사를 촉진하고, 인슐린의 민감도가 증가한 결과 인슐린 저항성이 개선되었다고 볼 수 있다. 본 연구의 결과가 선행연구와 유사한 것을 미루어 봤을 때 복합운동이 골격근의 세포막으로 GLUT4(glucose transporter type 4)의 전위를 자극하여(Shimomura et al., 2021) 골격근 내로 혈관 밀도의 증가가 글루코스의 흡수를 증가시켜서 폐경 후 비만 중년여성의 글루코스, 인슐린, HOMA-IR에 긍정적 영향을 미치게 되어 대사질환의 예방과 개선에 도움을 준 것으로 사료된다.
렙틴(leptin)은 대부분 지방 조직에서 생성되는 167개의 아미노산 펩타이드로써(Dalamaga et al., 2013) 지방량 및 체지방량에 정비례하여 정상인보다 비만인에게서 많이 분비된다(정찬경 및 염정환, 2015). 렙틴은 시상하부(hypothalamus)의 포만 중추를 자극하여 음식 섭취를 감소시키는 식욕 억제의 역할을 통해 체지방을 조절하고(Pereira, Cline, Glavas, Covey, & Kieffer, 2021), 체내의 교감 신경 활동과 발열 반응을 통해 활동량을 증가시켜서 에너지 소비를 자극한다(Fischer, Cannon, & Nedergaard, 2020). 또한, 렙틴은 췌장의 β 세포에서 인슐린 분비를 억제하여 골격근으로 글루코스 흡수 및 이용과 글리코겐 합성에도 영향을 미치게 되어 인슐린 감수성을 증가시키는데 기여한다(D'souza, Neumann, Glavas, & Kieffer, 2017). 이처럼 렙틴은 체내에서 신경 내분비 및 대사 조절에 중요한 역할을 하지만 비만에 있어 렙틴의 증가는 심혈관질환 및 대사 장애에 영향을 주게 된다(Zhao, Kusminski, & Scherer, 2021). 본 연구의 결과 렙틴의 수치가 운동군에서 유의하게 감소하였고, 대조군의 경우 유의한 차이가 없었는데 이는 복합운동이 혈중에 유리된 포도당을 조직 세포 내로 유입을 촉진하여 지방 대사의 활성화로 지방 조직의 감소를 촉진하고, 제지방량을 유지함으로써 인슐린의 분비를 억제하여 렙틴의 농도를 감소시켰기 때문이다(Weiss, Reeds, Ezekiel, Albert, & Villareal, 2017). 또한, 비만에 있어 렙틴은 뇌혈관장벽(blood-brain barrier; BBB)을 통과하여 뇌의 시상하부에 렙틴 수용체와 결합해야 하는 특징을 가지고 있는데 렙틴의 수송을 방해하는 중성지방(triglycerides; TG)에 의해서 뇌혈관장벽에 도달하지 못하게 되어 렙틴 저항성이 생기게 된다(김용운, 2013). 이는 본 연구에서 대상자가 비만임을 고려해봤을 때 비만은 렙틴 저항성에 의해서 렙틴 감수성이 저하되고, 식욕조절이 원활하게 이루어지지 않는데(안나영 및 김기진, 2018) 본 연구의 운동군에서 렙틴의 수치가 감소된 것은 복합운동의 효과가 렙틴의 수송을 도와 렙틴 수용체에 영향을 주게 되어 렙틴의 개선이 나타난 것으로 생각된다. 또한, 운동을 통해 지방 조직의 감소가 렙틴의 민감성을 높이게 되고, 이는 렙틴의 본질적인 작용인 식욕 억제의 기능으로 인해 체지방의 감소에도 도움이 되었을 것이다(Kang, Park, Sung, Yuan, & Lim, 2021). 이를 종합해보면 복합운동을 통해 시상하부에 있는 렙틴 수용체에 영향을 주어 렙틴의 신호전달 경로를 직접 활성화하고, 렙틴 저항성과 감수성을 개선하게 되어 렙틴의 농도를 감소시켜 비만을 개선시킬 수 있었다고 생각된다.
운동에 따른 렙틴의 선행연구 결과를 살펴보면 폐경 후 비만 중년여성을 대상으로 16주간 저강도의 복합운동을 실시한 결과 체조성의 변화와 골격근의 증가를 일으켜 렙틴의 감소에 영향을 주었고(김명수 및 양승원, 2009), 비만 중년여성을 대상으로 12주간 복합운동을 실시한 결과 체중 및 체지방율의 감소와 에너지 소비율의 증가를 유도하여 렙틴의 농도를 감소시켰다고 보고하였다(김형돈, 김종식, 김덕중 및 조현철, 2011). 이러한 결과는 장기간의 규칙적인 운동이 폐경 후 비만 중년여성의 지방 조직의 분해를 촉진시켜 체지방의 감소가 렙틴의 감소로 이어져 비만을 완화시키는데 영향을 미친 것으로 생각된다. 선행연구와 본 연구의 결과가 유사한 것을 미루어 봤을 때 본 연구의 복합운동 강도를 저, 중, 고강도로 설정한 것이 신체활동량 및 신진대사를 증가시켜 체내의 에너지 수준에 반응하는 신경 내분비계의 민감도를 증가시켜 렙틴에 대한 감수성이 향상되어 비만과 제2형 당뇨병과 같은 성인병, 대사질환으로 진전될 가능성을 감소시키는 작용을 한 것으로 사료된다.
GLP-1(glucagon like peptide-1)은 음식 섭취 후에 영양분이 장관 내에서 흡수되는 동안에 소화기관에서 분비되는 인크레틴(incretin) 호르몬 중 하나다(오승준, 2011). GLP-1은 섭취한 음식의 양에 비례하여 분비되는 포만 인자이며(Krieger, 2020) DPP-4(dipeptidyl peptidase-4)에 의해서 빠르게 분해되어 체내에서 작용하는 시간은 매우 짧다(이상아, 2013). 체내에 음식이 들어오면 포도당 의존적인 방식으로 인슐린 분비를 촉진시키고, 글리코겐 분해 및 포도당 생성을 증가시키는 글루카곤(glucagon) 분비를 억제하여 혈당을 조절한다(김현아 및 김헌성, 2011). 또한, 위장관 운동을 통해 뇌의 중추신경계에 포만감을 유지하게 하여 식욕 억제하는 효과와 더불어 체중 감소에도 영향을 준다(Gonzalez-Garcia, Milbank, Dieguez, Lopez, & Contreras, 2019).
본 연구에서 GLP-1의 수치가 운동군에서 유의하게 감소하였고, 대조군의 경우 유의한 차이가 없었다. 장 호르몬인 GLP-1은 다양한 생리학적 과정에 영향을 주지만(Martin, Sun, & Keating, 2020) 비만은 장과 뇌 사이의 신경 내분비계의 신호전달 경로를 방해하게 되어 GLP-1의 활동을 저하시키게 된다(de Lartigue, 2016). 또한, 비만인의 GLP-1 결핍이 위 배출 속도를 증가시켜 다음 음식 섭취의 조기 발병을 촉진하고, 과식하는데도 영향을 주어 비만을 더욱 악화시키게 된다(Madsbad, 2014).
본 연구에서 운동군이 GLP-1의 감소가 일어난 것을 미루어 봤을 때 규칙적인 복합운동의 다양한 신체적 움직임이 에너지 소비량을 증가시키고, 음식 섭취량을 감소시킨 결과 체지방의 감소가 일어나(Esquivel, 2021) 생리적인 식욕 수준의 저하로 이어져 GLP-1의 감소를 나타내었다고 생각된다(김남익, 2012). 이러한 결과는 GLP-1이 체내의 포도당 의존성으로 분비되므로(Drucker, 2016) 복합운동을 통해 음의 에너지 균형으로 인하여 식욕 저하가 일어나 GLP-1의 감소로 나타난 것으로 보여진다(Adam, Jocken, & Westerterp‐Plantenga, 2005).
운동에 따른 GLP-1의 선행연구 결과를 살펴보면 폐경 후 비만 중년여성을 대상으로 8주간 순환운동을 실시한 결과 체지방 감소로 인하여 GLP-1의 수준이 감소되었다고 보고하였다(김정호, 2012). 이와 반대로 비만 중년여성을 대상으로 12주간 복합운동을 실시한 결과 체지방과 체지방률의 감소가 GLP-1의 수치가 증가하였다고 보고하여(임승택 및 정현훈, 2012) 선행연구와는 상이한 결과가 나타났다. 이처럼 운동에 대한 내인성 GLP-1은 수치의 증가와 감소에 대해 명확하게 구분하기 어렵다고 판단되어 운동에 관한 GLP-1의 연구가 보다 많이 필요하다고 생각된다.
본 연구에서는 폐경 후 비만 중년여성을 대상으로 11주간 복합운동의 점진 부하 운동방법에 의한 신체활동량의 증가가 지방 대사의 활성화를 일으켰고, 에너지 소비량의 증가와 식욕 억제가 일어난 부적 에너지 균형으로 이어져 궁극적으로 GLP-1이 감소한 것으로 사료된다.
Ⅴ. 결론
본 연구는 11주간의 복합운동이 인슐린 저항성, 렙틴, GLP-1에 미치는 영향을 구명하기 위해 만 55세 이상 65세 미만의 폐경 후 비만 중년여성을 대상으로 운동군(n=12), 대조군(n=12)으로 구분하여 실시한 결과는 다음과 같다. 인슐린 저항성에서 글루코스, 인슐린, HOMA-IR은 그룹×시기 간 상호작용 효과가 나타났고, 시기 간 주효과가 나타났다. 운동 전·후 시기 간 차이에서 운동군이 11주 후 유의하게 감소하여 긍정적인 영향을 나타냈으며 그룹 간 차이는 11주 후 변화량에서 유의한 차이가 나타났다. 렙틴은 그룹×시기 간 상호작용 효과가 나타났고, 운동 전·후 시기 간 차이에서 운동군이 11주 후 유의하게 감소하여 긍정적인 영향을 나타냈으며 그룹 간 차이는 11주 후 변화량에서 유의한 차이가 나타났다. 또한, GLP-1은 그룹×시기 간 상호작용 효과가 나타났고, 시기 간 주효과가 나타났다. 운동 전·후 시기 간 차이에서 운동군이 11주 후 유의하게 감소하였으며 그룹 간 차이는 11주 후 변화량에서 유의한 차이가 나타났다.
이상의 결과를 종합해볼 때 11주간의 트레드밀 걷기운동과 탄력밴드운동으로 구성된 복합운동이 폐경 후 비만 중년여성의 비만 관련 인자인 인슐린 저항성, 렙틴, GLP-1에 긍정적인 영향을 주어 비만의 개선과 더 나아가 제2형 당뇨병의 예방에 효과적이므로 중년의 삶을 건강하게 영위하는데 도움을 줄 것으로 생각된다.
참고문헌
- 강설중, 정성림(2010). 12주간 유산소 운동이 비만 청소년의 비만 지표, 인슐린저항성, 심혈관질환 위험인자 및 운동능력에 미치는 영향. 운동과학, 19(3), 277-288.
- 권정현(2021). 12주간의 걷기운동 생활습관이 마른비만 여대생의 혈압, 혈중지질 및 신체조성에 미치는 영향. 한국체육과학회지, 30(5), 1121-1131.
- 김남익(2012). 비만 중년 여성들의 복합 트레이닝이 신체조성 지표 및 식욕조절 호르몬에 미치는 영향. 한국스포츠학회지, 10(3), 507-518.
- 김도은(2017). 유, 무산소 복합운동이 중년여성의 신체구성, 체력에 미치는 영향. 한국유산소운동과학회지, 15(1), 67-74.
- 김명수, 양승원(2009). 페경 후 저강도 복합운동이 비만 중년여성의 신체조성, 혈중지질, 글로코스 및 렙틴에 미치는 효과. 한국사회체육학회지, 38(2), 951-960.
- 김용운(2013). 렙틴 저항성의 개선. 영남의대학술지, 30(1), 4-9.
- 김원현, 김승석(2016). 12주간 복합운동이 비만여대생의 신체조성 및 기초체력 향상에 미치는 영향. 디지털융복합연구, 14(4), 471-478.
- 김정숙, 김도연, 하수민(2019). 비만을 동반한 제2형 당뇨 여성노인의 밴드 저항운동이 C-peptide, 인슐린 분비능 및 인슐린 저항성에 미치는 영향. 한국여성체육학회지, 33(4), 117-195.
- 김정호(2012). 순환운동이 중년비만여성의 인슐린저항성과 혈중 글루카곤 및 Glucagon Like Peptide-1(GLP-1)에 미치는 영향. 미간행 석사학위논문, 연세대학교, 서울.
- 김철주, 김현우(2017). 8주간 걷기운동이 비만 노인여성의 혈중지질과 당화혈색소에 미치는 영향. 한국스포츠학회지, 15(2), 609-616.
- 김현아, 김헌성(2011). 제2형 당뇨병 환자에게 인크레틴 기반 약물치료요법. 한국임상약학회지, 21(2), 57-65.
- 김현준, 신재숙(2021). 비만청소년의 12주 복합운동이 대사증후군 위험인자, 인슐린저항성 및 BDNF에 미치는 영향. 한국체육과학회지, 30(3), 1195-1204.
- 김형돈, 김종식, 김덕중, 조현철(2011). 비만 중년여성들의 복합운동 프로그램이 비만관련인자에 미치는 영향. 한국사회체육학회지, 45(2), 811-820.
- 대한비만학회(2020). 비만 진료지침 2020.
- 보건복지부(2019). 2019 국민건강통계.
- 서정훈, 김동현, 박해용, 이승신, 정지윤(2016). BMI와 체성분분석에 의한 지방량 및 근육량의 만성질환 예측지표로서 유용성 비교. 고양: 국민건강보험 일반병원 연구소.
- 신덕수, 이창준, 임관철, 노동진, 김세민, 김신(2013). 복합운동 프로그램이 비만 중년여성의 신체조성, 동맥경화지수 및 인슐린저항성에 미치는 영향. 한국체육과학회지, 22(2), 1217-1228.
- 신석민, 김병수(2015). 비만 예방 교육 및 유산소 복합운동이 중년 비만여성의 기초체력, 신체조성 및 혈액성분에 미치는 영향. 한국체육과학회지, 24(3), 1569-1578.
- 신재숙(2020). 비만중년여성의 12주 복합운동에 따른 기간별 인슐린 저항성과 GLP-1 변화비교. 한국체육과학회지, 29(3), 1087-1096.
- 안나영, 김기진(2018). 아동의 인슐린 저항성과 신체구성, 체력 및 렙틴 농도의 관련성. 코칭능력개발지, 20(1), 56-63.
- 오승준(2011). 인크레틴을 이용한 새로운 당뇨병 치료제. 대한내과학회지, 80(6), 625-634.
- 위승준, 이병선, 이만균(2019). 유산소운동과 저항성운동의 순서가 운동 후 혈압, 혈중 젖산농도 및 에너지 대사량에 미치는 영향. 한국체육과학회지, 28(2), 1067-1077.
- 이상아(2013). 인크레틴계 약물의 최신기전; DPP-4 억제제의 임상효과. 당뇨병(JKD), 14(3), 128-132.
- 이승범(2014). 중·고강도 유산소 운동이 인슐린저항성, 면역기능 및 염증성 사이토카인에 미치는 영향. 한국웰니스학회지, 9(2), 213-242.
- 이영섭, 곽종형(2021). 탄력밴드운동을 이용한 상지운동이 여성치매노인의 인지기능과 체력 및 일상생활활동에 미치는 영향. 한국사회복지경영학회, 8(2), 299-318.
- 이정화, 김경혜, 김경덕(2014). 중년여성의 갱년기 증상과 삶의 질의 관계에 대한 인지기능의 매개효과. 한국산학기술학회, 15(7), 4439-4448.
- 이주연, 신상근(2019). 유산소운동과 저항운동이 여성노인의 인슐린저항성인자와 아디포카인에 미치는 영향. 한국발육발달학회지, 27(3), 207-219.
- 이한(2011). 줄넘기 운동이 비만아동의 신체조성, 혈중 지질성분 및 인슐린 저항성에 미치는 영향. 한국체육과학회지, 20(3), 1239-1248.
- 이향범, 정원정, 권오석(2018). 복합 트레이닝 중년여성의 건강체력과 동맥경화지수 및 인슐린저항성에 미치는 영향. 한국체육과학회지, 27(4), 957-967.
- 임승택, 정현훈(2012). 복합운동이 비만 중년여성의 건강관련체력과 인슐린 저항성 및 GLP-1에 미치는 영향. 한국체육과학회지, 21(4), 1139-1147.
- 정찬경, 염정환(2015). 12주간 복합운동 및 Policosanol 섭취가 비만 중년여성의 염증표지인자 및 렙틴에 미치는 영향. 디지털융복합연구, 13(4), 387-393.
- 정현령, 류종우, 유동훈, 신영호, 강호율(2012). 12주 걷기 운동이 폐경 후 비만 여성의 식욕조절 호르몬, 아디포카인 및 인슐린 저항성에 미치는 영향. 운동과학, 21(2), 213-222.
- 조재혁(2016). 12주간의 복합운동프로그램이 중년비만여성의 인슐린저항성에 미치는 영향. 한국스포츠학회지, 14(3), 581-589.
- 최철수(2009). 인슐린저항성의 발생기전. 대한내과학회지, 77(2), 171-177.
- 하수민, 김정숙, 하민성, 김보성, 김도연(2019). 복합운동이 제2형 당뇨병 비만 여성노인의 Irisin, 신체조성 및 당 대사에 미치는 영향. 한국응용과학기술학회지, 36(4), 1268-1280.
- 한명석(2011). 폐경으로 인한 대사증후군. 대한폐경학회지, 17(3), 127-135.
- 한은상, 서현(2019). 탄력밴드를 활용한 복합운동이 비만 중년여성의 혈중 중성지방 개선과 신체조성 발달에 미치는 영향. 한국발육발달학회지, 27(4), 329-333.
-
Adam, T. C., Jocken, J., & Westerterp‐Plantenga, M. S.(2005). Decreased glucagon‐like peptide 1 release after weight loss in overweight/obese subjects. Obesity Research, 13(4), 710-716.
[https://doi.org/10.1038/oby.2005.80]

- American College of Sports Medicine.(2018). ACSM’s Guideline for Exercise Testing and Prescription 10th. Philadelphia: Wolters Kluwer.
-
Azuma, K., Radikova, Z., Mancino, J., Toledo, F. G., Thomas, E., Kangani, C., Dalla Man, C., Cobell,i C., Holst, JJ., Deacon, CF., He, Y., Ligueros-Saylan, M, Serra, D., Foley, JE., Kelley, DE., & Kelley, D., E.(2008). Measurements of islet function and glucose metabolism with the dipeptidyl peptidase 4 inhibitor vildagliptin in patients with type 2 diabetes. The Journal of Clinical Endocrinology & Metabolism, 93(2), 459-464.
[https://doi.org/10.1210/jc.2007-1369]

-
Colado, J. C., Garcia-Masso, X., Triplett, T. N., Flandez, J., Borreani, S., & Tella, V.(2012). Concurrent validation of the OMNI-resistance exercise scale of perceived exertion with Thera-band resistance bands. The Journal of Strength & Conditioning Research, 26(11), 3018-3024.
[https://doi.org/10.1519/JSC.0b013e318245c0c9]

-
Czech, M. P.(2017). Insulin action and resistance in obesity and type 2 diabetes. Nature Medicine, 23(7), 804-814.
[https://doi.org/10.1038/nm.4350]

-
Dalamaga, M., Chou, S. H., Shields, K., Papageorgiou, P., Polyzos, S. A., & Mantzoros, C. S.(2013). Leptin at the intersection of neuroendocrinology and metabolism: current evidence and therapeutic perspectives. Cell Metabolism, 18(1), 29-42.
[https://doi.org/10.1016/j.cmet.2013.05.010]

-
de Lartigue, G.(2016). Role of the vagus nerve in the development and treatment of diet‐induced obesity. The Journal of Physiology, 594(20), 5791-5815.
[https://doi.org/10.1113/JP271538]

-
Drucker, D. J.(2016). The cardiovascular biology of glucagon-like peptide-1. Cell Metabolism, 24(1), 15-30.
[https://doi.org/10.1016/j.cmet.2016.06.009]

-
D'souza, A. M., Neumann, U. H., Glavas, M. M., & Kieffer, T. J.(2017). The glucoregulatory actions of leptin. Molecular Metabolism, 6(9), 1052-1065.
[https://doi.org/10.1016/j.molmet.2017.04.011]

-
Esquivel, M. K.(2021). Energy balance dynamics: exercise, appetite, diet, and weight control. American Journal of Lifestyle Medicine, 15(3), 220-223.
[https://doi.org/10.1177/1559827621989285]

-
Fairbrother, U., Kidd, E., Malagamuwa, T., & Walley, A.(2018). Genetics of severe obesity. Current Diabetes Reports, 18(10), 1-9.
[https://doi.org/10.1007/s11892-018-1053-x]

-
Fischer, A. W., Cannon, B., & Nedergaard, J.(2020). Leptin: is it thermogenic?. Endocrine Reviews, 41(2), 232-260.
[https://doi.org/10.1210/endrev/bnz016]

-
Frasca, D., Ferracci, F., Diaz, A., Romero, M., Lechner, S., & Blomberg, B. B.(2016). Obesity decrease B cell responses in young and elderly individuals. Obesity, 24(3), 615-625.
[https://doi.org/10.1002/oby.21383]

-
Friedman, J. M.(2009). Causes and control of excess body fat. Nature, 459(7245), 340-342.
[https://doi.org/10.1038/459340a]

-
Geraci, A., Calvani, R., Ferri, E., Marzetti, E., Arosio, B., & Cesari, M.(2021). Sarcopenia and menopause: the role of estradiol. Frontiers in Endocrinology, 12, 588.
[https://doi.org/10.3389/fendo.2021.682012]

-
Gonzalez-Garcia, I., Milbank, E., Dieguez, C., Lopez, M., & Contreras, C.(2019). Glucagon, glp-1 and thermogenesis. International Journal of Molecular Sciences, 20(14), 3445-3461.
[https://doi.org/10.3390/ijms20143445]

-
Goossens, G. H.(2017). The metabolic phenotype in obesity: fat mass, body fat distribution, and adipose tissue function. Obesity Facts, 10(3), 207-215.
[https://doi.org/10.1159/000471488]

-
Hamasaki, H.(2018). Exercise and glucagon-like peptide-1: does exercise potentiate the effect of treatment?. World Journal of Diabetes, 9(8), 138-140.
[https://doi.org/10.4239/wjd.v9.i8.138]

-
Hong, S. C., Yoo, S. W., Cho, G. J., Kim, T., Hur, J. Y., Park, Y. K., Lee. K. W., & Kim, S. H.(2007). Correlation between estrogens and serum adipocytokines in premenopausal and postmenopausal women. Menopause, 14(5), 835-840.
[https://doi.org/10.1097/gme.0b013e31802cddca]

-
Kang, S., Park, K. M., Sung, K. Y., Yuan, Y., & Lim, S. T.(2021). Effect of resistance exercise on the lipolysis pathway in obese pre-and postmenopausal women. Journal of Personalized Medicine, 11(9), 874-885.
[https://doi.org/10.3390/jpm11090874]

-
Kasacka, I., Piotrowska, Z., Niezgoda, M., & Lebkowski, W.(2019). Differences in leptin biosynthesis in the stomach and in serum leptin level between men and women. Journal of Gastroenterology and Hepatology, 34(11), 1922-1928.
[https://doi.org/10.1111/jgh.14688]

-
Katsiki, N., Mikhailidis, D. P., & Banach, M.(2018). Leptin, cardiovascular diseases and type 2 diabetes mellitus. Acta Pharmacologica Sinica, 39(7), 1176-1188.
[https://doi.org/10.1038/aps.2018.40]

-
Ko, S. H., & Kim, H. S.(2020). Menopause-associated lipid metabolic disorders and foods beneficial for postmenopausal women. Nutrients, 12(1), 202-227.
[https://doi.org/10.3390/nu12010202]

-
Kolb, H., Kempf, K., Rohling, M., & Martin, S.(2020). Insulin: too much of a good thing is bad. BMC Medicine, 18(1), 1-12.
[https://doi.org/10.1186/s12916-020-01688-6]

-
Konner, A. C., & Bruning, J. C.(2012). Selective insulin and leptin resistance in metabolic disorders. Cell Metabolism, 16(2), 144-152.
[https://doi.org/10.1016/j.cmet.2012.07.004]

-
Krieger, J. P.(2020). Intestinal glucagon-like peptide-1 effects on food intake: physiological relevance and emerging mechanisms. Peptides, 131, 170342.
[https://doi.org/10.1016/j.peptides.2020.170342]

-
Lee, Y. S., & Jun, H. S.(2014). Anti-diabetic actions of glucagon-like peptide-1 on pancreatic beta-cells. Metabolism, 63(1), 9-19.
[https://doi.org/10.1016/j.metabol.2013.09.010]

-
Li, S., Kim, J. Y., & Sim, Y. J.(2020). Effects of 10-week combined training on lipid metabolic regulatory hormones and metabolic syndrome index according to exercise dose in obese male college students. Journal of Exercise Rehabilitation, 16(1), 101-107.
[https://doi.org/10.12965/jer.2040008.004]

-
Lizcano, F., & Guzman, G.(2014). Estrogen deficiency and the origin of obesity during menopause. Biomed Research International, 2014, 1-11.
[https://doi.org/10.1155/2014/757461]

-
Madsbad, S.(2014). The role of glucagon‐like peptide‐1 impairment in obesity and potential therapeutic implications. Diabetes, Obesity and Metabolism, 16(1), 9-21.
[https://doi.org/10.1111/dom.12119]

-
Martin, A. M., Sun, E. W., & Keating, D. J.(2020). Mechanisms controlling hormone secretion in human gut and its relevance to metabolism. Journal of Endocrinology, 244(1), R1-R15.
[https://doi.org/10.1530/JOE-19-0399]

-
Matthews, D. R., Hosker, J. P., Rudenski, A. S., Naylor, B. A., Treacher, D. F., & Turner, R. C.(1985). Homeostasis model assessment: insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia, 28(7), 412-419.
[https://doi.org/10.1007/BF00280883]

- Newsholme, P., & Krause, M.(2012). Nutritional regulation of insulin secretion: implications for diabetes. The Clinical Biochemist Reviews, 33(2), 35-47.
-
Pereira, S., Cline, D. L., Glavas, M. M., Covey, S. D., & Kieffer, T. J.(2021). Tissue-specific effects of leptin on glucose and lipid metabolism. Endocrine Reviews, 42(1), 1-28.
[https://doi.org/10.1210/endrev/bnaa027]

-
Queipo-Ortuno, M. I., Seoane, L. M., Murri, M., Pardo, M., Gomez-Zumaquero, J. M., Cardona, F., Casanueva F., & Tinahones, F. J.(2013). Gut microbiota composition in male rat models under different nutritional status and physical activity and its association with serum leptin and ghrelin levels. Plos One, 8(5), e65465.
[https://doi.org/10.1371/journal.pone.0065465]

-
Roberts, C. K., Hevener, A. L., & Barnard, R. J.(2013). Metabolic syndrome and insulin resistance: underlying causes and modification by exercise training. Comprehensive Physiology, 3(1), 1-58.
[https://doi.org/10.1002/cphy.c110062]

-
Shimomura, M., Horii, N., Fujie, S., Inoue, K., Hasegawa, N., Iemitsu, K., Uchida, M., & Iemitsu, M.(2021). Decreased muscle‐derived musclin by chronic resistance exercise is associated with improved insulin resistance in rats with type 2 diabetes. Physiological Reports, 9(9), e14823.
[https://doi.org/10.14814/phy2.14823]

-
Smith, N. K., Hackett, T. A., Galli, A., & Flynn, C. R.(2019). GLP-1: molecular mechanisms and outcomes of a complex signaling system. Neurochemistry International, 128(2019), 94-105.
[https://doi.org/10.1016/j.neuint.2019.04.010]

-
Weiss, E. P., Reeds, D. N., Ezekiel, U. R., Albert, S. G., & Villareal, D. T.(2017). Circulating cytokines as determinants of weight loss-induced improvements in insulin sensitivity. Endocrine, 55(1), 153-164.
[https://doi.org/10.1007/s12020-016-1093-4]

-
Zhao, S., Kusminski, C. M., & Scherer, P. E.(2021). Adiponectin, leptin and cardiovascular disorders. Circulation Research, 128(1), 136-149.
[https://doi.org/10.1161/CIRCRESAHA.120.314458]